题目内容
【题目】【2017浙江模拟】在含3molNaHSO3的溶液中加入含a mol NaIO3的溶液充分反应(不考虑I2+I﹣I3﹣),所得溶液中的I﹣与加入NaIO3的物质的量的关系曲线如图所示,下列说法不正确的是( )
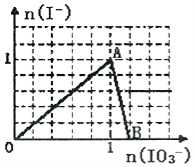
A.还原性HSO3﹣>I﹣,氧化性:IO3﹣>SO42﹣>I2
B.当a=1时,溶液中n(I2):n(I﹣)=3:5
C.AB段,反应的离子方程式为:IO3﹣+5I﹣+6H+═3I2+3H2O
D.l<a<1.2时,溶液中SO42﹣与I﹣的物质的量之比为3:(6﹣5a)
【答案】A
【解析】A.根据氧化还原反应中强制弱的原理,在反应:IO3﹣+3HSO3﹣═I﹣+3SO42﹣+3H+中,还原性HSO3﹣>I﹣,氧化性:IO3﹣>SO42﹣,而碘水与二氧化硫反应生成氢碘酸和硫酸,可知氧化性:SO42﹣<I2,故A错误;B.当a=1时,溶液中n(I2):n(I﹣)=3:5,由反应IO3﹣+3HSO3﹣═I﹣+3SO42﹣+3H+可知,反应生成1mol的碘离子,则生成![]() mol的碘单质,所以溶液中n(I2):n(I﹣)=3:5,故B正确;C.AB段,生成的碘离子被碘酸根离子氧化,反应的离子方程式为:IO3﹣+5I﹣+6H+═3I2+3H2O,故C正确;D.l<a<1.2时,溶液中SO42﹣的物质的量为3mol,而生成I﹣的物质的量为:1mol,余IO3﹣的物质的量为:(a﹣1)mol,则0<a﹣1<0.2时,由反应IO3﹣+6H++5I﹣═3H2O+3I2,碘离子过量,所以反应的碘离子的物质的量为:5(a﹣1)mol,此时溶液中碘离子的物质的量为:(6﹣5a)mol,则SO42﹣与I﹣的物质的量之比为3:(6﹣5a),故D正确;故选A。
mol的碘单质,所以溶液中n(I2):n(I﹣)=3:5,故B正确;C.AB段,生成的碘离子被碘酸根离子氧化,反应的离子方程式为:IO3﹣+5I﹣+6H+═3I2+3H2O,故C正确;D.l<a<1.2时,溶液中SO42﹣的物质的量为3mol,而生成I﹣的物质的量为:1mol,余IO3﹣的物质的量为:(a﹣1)mol,则0<a﹣1<0.2时,由反应IO3﹣+6H++5I﹣═3H2O+3I2,碘离子过量,所以反应的碘离子的物质的量为:5(a﹣1)mol,此时溶液中碘离子的物质的量为:(6﹣5a)mol,则SO42﹣与I﹣的物质的量之比为3:(6﹣5a),故D正确;故选A。

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目