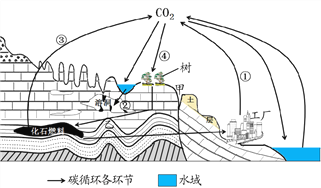
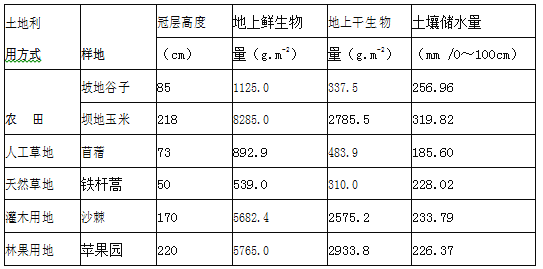
��Ŀ����
����Ŀ��������һ�ַdz���Ҫ�Ļ���ԭ�ϣ���ش��������⣺
��1��ʵ�����ö������̺�Ũ����Ϊԭ����ȡ��������д����Ӧ�Ļ�ѧ����ʽ ��
��2��������ͨ��Ʒ����Һ��Ʒ����ɫ�������õ����� �� SO2Ҳ��ʹƷ����ɫ�����ǽ�������SO2�������ϣ�ͨ��ˮ�к�ˮ��Һ������Ư�����ã����Ʋ��ڴ˹����У�������SO2������ˮ����Ӧ�����ӷ���ʽ�� ��
��3����ҵ��������ʯ������Ư�ۣ�Ư�۵���Ч�ɷ��� ��
��4����FeI2��Һ��ͨ�����������ʱ���������Ļ�ѧ��Ӧ�ķ���ʽ�� ��
���𰸡�
��1��MnO2+4HCl��Ũ�� ![]() MnCl2��+Cl2+2H2O
MnCl2��+Cl2+2H2O
��2������� SO2+Cl2+2H2O�T4H++SO42��+2Cl��
��3��Ca��ClO��2
��4��2FeI2+3Cl2=2FeCl3+2I2
���������⣺��1������������Ũ�����ڼ��������·�Ӧ�����������Ȼ��̺�ˮ������ʽMnO2+4HCl��Ũ�� ![]() MnCl2��+Cl2+2H2O��
MnCl2��+Cl2+2H2O��
���Դ��ǣ�MnO2+4HCl��Ũ�� ![]() MnCl2��+Cl2+2H2O����2��������ͨ��Ʒ����Һ��Ʒ����ɫ�������õ��������ɵĴ����ᣬSO2��Cl2����Һ�з�����������ԭ��Ӧ��������������ᣬ���ӷ�ӦΪSO2+Cl2+2H2O�T4H++SO42��+2Cl�������Դ��ǣ������SO2+Cl2+2H2O�T4H++SO42��+2Cl������3����������ʯ����Ϊԭ������Ư�ۣ���Ӧ����CaCl2��Ca��ClO��2��H2O��Ư�۵���Ч�ɷ���Ca��ClO��2�����Դ��ǣ�Ca��ClO��2����4����FeI2��Һ��ͨ�����������ʱ����ԭ�Եĵ����Ӻ���������ȫ����Ӧ������Һ�з����Ļ�ѧ��Ӧ�ɱ�ʾΪ2FeI2+3Cl2=2FeCl3+2I2�����Դ��ǣ�2FeI2+3Cl2=2FeCl3+2I2��
MnCl2��+Cl2+2H2O����2��������ͨ��Ʒ����Һ��Ʒ����ɫ�������õ��������ɵĴ����ᣬSO2��Cl2����Һ�з�����������ԭ��Ӧ��������������ᣬ���ӷ�ӦΪSO2+Cl2+2H2O�T4H++SO42��+2Cl�������Դ��ǣ������SO2+Cl2+2H2O�T4H++SO42��+2Cl������3����������ʯ����Ϊԭ������Ư�ۣ���Ӧ����CaCl2��Ca��ClO��2��H2O��Ư�۵���Ч�ɷ���Ca��ClO��2�����Դ��ǣ�Ca��ClO��2����4����FeI2��Һ��ͨ�����������ʱ����ԭ�Եĵ����Ӻ���������ȫ����Ӧ������Һ�з����Ļ�ѧ��Ӧ�ɱ�ʾΪ2FeI2+3Cl2=2FeCl3+2I2�����Դ��ǣ�2FeI2+3Cl2=2FeCl3+2I2��
�����㾫����ͨ��������������Ļ�ѧ���ʣ����������Ļ�ѧ���ʣ��������Ӧ�����������ɸ�̬���ǽ�����Ӧ����ˮ��Ӧ����Ӧ���뻹ԭ�����ʷ�Ӧ�����Խ����⣮

 ��У����ϵ�д�
��У����ϵ�д�