题目内容
【题目】(1)碳酸钠溶液中各离子按照浓度从大到小的顺序依次为: ________________。
(2)下表是几种常见弱酸的电离平衡常数(25℃)
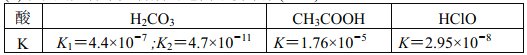
根据分析表格中数据可知,H2CO3、CH3COOH、HClO 三种酸的酸性从强到弱依次是_______________;25℃时, 等浓度的Na2CO3、NaAc 和NaClO三种溶液的pH从小到大依次是___________________。
(3)常温下,将0.02 mol·L-1 的 Ba(OH)2溶液100 mL和0.02 mol·L-1的NaHSO4溶液100 mL混合,若忽略溶液体积变化,则混合后的溶液的 pH 为___________。
(4)25℃时, Ksp[Mg(OH)2]=5.61×10-12, Ksp[MgF2]=7.42×10-11。 该温度下饱和Mg(OH)2溶液与饱和 MgF2溶液相比, _________(填化学式)溶液中的 c(Mg2+)大。
【答案】c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+) CH3COOH> H2CO3>HClO
NaAc﹤NaClO ﹤Na2CO3 12 MgF2
【解析】
试题分析:(1)根据碳酸根水解分析;
(2)电离常数越大,酸性越强,酸性越强,相应酸根的水解程度越小;
(3)首先计算反应后氢氧根浓度,然后依据水的离子积常数计算氢离子的浓度;
(4)根据溶度积常数进行比较。
解析:(1)碳酸钠溶液中碳酸根水解,溶液显碱性,且水解分步进行,因此各离子按照浓度从大到小的顺序依次为 c(Na+)> c(CO32-)> c(OH-)>c(HCO3-)> c(H+)。
(2)根据弱酸的电离平衡常数可知酸性是CH3COOH>H2CO3>HClO&>HCO3-,所以H2CO3、CH3COOH、HClO 三种酸的酸性从强到弱依次是CH3COOH>H2CO3>HClO;酸性越弱,相应酸根越容易水解,溶液的碱性越强,则25℃时,等浓度的Na2CO3、NaAc和NaClO三种溶液的pH从小到大依次是 NaAc<NaClO<Na2CO3。
(3)常温下,将0.02 mol·L-1的Ba(OH)2溶液100 mL和0.02 mol·L-1的NaHSO4溶液100 mL混合,反应后氢氧根过量,氢氧根浓度是![]() ,所以氢离子浓度是10-12mol/L,则混合后的溶液的 pH=12。
,所以氢离子浓度是10-12mol/L,则混合后的溶液的 pH=12。
(4)由于氢氧化镁和氟化镁的组成相似,可以直接通过比较溶度积常数判断饱和溶液中镁离子浓度,所以根据溶度积常数可知该温度下饱和MgF2溶液中的c(Mg2+)大。