题目内容
【题目】铜有多种化合物,氧化亚铜(Cu2O)、氯化亚铜(CuCl)、氯化铜(CuCl2)、CuSO4等。完成下列计算:
(1)波尔多液是由硫酸铜、生石灰和水配制成杀菌剂,不同情况下需要配制不同的比例。现配制按质量比CuSO4:CaO:H2O=1:2:200的波尔多液50 kg。
需要用CuSO4·5H2O________g,CaO________mol。
(2)某工厂以精辉铜矿(主要成分为Cu2S)为原料冶炼金属铜,精辉铜矿中含23%杂质,日均产含Cu量97.5%的精铜42 t。
已知:总反应式Cu2S+O2=2Cu+SO2
日均需精辉铜矿________t,日均产SO2标准状况下体积________L。
(3)印刷线路板的铜能被FeCl3的溶液腐蚀,将印刷线板浸入200 mL FeCl3溶液中,有11.2 g Cu被腐蚀掉。取出印刷线路板,向溶液中加入11.2 g铁粉,充分反应溶液中还有4.8 g不溶物。计算原FeCl3溶液的物质的量浓度。
(4)制备铜的某化合物晶体。取5.12 g Cu、14.5 mol/L HNO3 15 mL、6.0 mol/L HCl 50 mL,混合后Cu完全反应,反应后溶液中有水54.32 g,再经水浴保温蒸发掉42 g水,冷却至20 ℃并过滤,得到8.12 g晶体。通过计算推断此晶体的化学式________。
已知:20 ℃溶解度
CuCl2·2H2O 73 g/100 g H2O
Cu(NO3)2·3H2O 125 g/100 g H2O
【答案】(1)385 8.8
(2)66.5 7.17×106
(3)剩余不溶物为Cu,共溶解Cu:11.2 g-4.8 g=5.6 g
物质的量6.4 g÷64 g/mol=0.1 mol
Fe:11.2 g 物质的量11.2 g÷56 g/mol=0.2 mol
c(FeCl3)=0.6 mol/0.2 L=3.0 mol/L
(4)混合后反应Cu+NO![]() +H+===Cu2++H2O+NOx↑
+H+===Cu2++H2O+NOx↑
剩余硝酸根量少且Cu(NO3)2·3H2O溶解度大,析出的是CuCl2晶体
设晶体化学式为CuCl2·xH2O
无水CuCl2 20 ℃溶解度为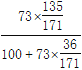 ×100=50.0 g/100 g H2O
×100=50.0 g/100 g H2O
生成CuCl2 5.12·135/64=10.8 g,剩余水54.32-42=12.32 g
 =
=![]() x=3 CuCl2·3H2O
x=3 CuCl2·3H2O
【解析】(1)CuSO4CaOH2O=1:2:200的波尔多液50 kg中硫酸铜的质量是50 kg×1/(1+2+200)=246.3 g,则硫酸铜的物质的量是246.3 g/160 g/mol,所以需要CuSO4·5H2O的质量是246.3 g/160 g/mol×250 g/mol=385 g;CaO的质量是硫酸铜质量的2倍,所以CaO的物质的量是246.3 g×2/56 g/mol=8.8 mol;(2)日均产含Cu量97.5%的粗铜42 t,则Cu的物质的量是42×105 g/64 g/mol×97.5%=6.4×105 mol,根据化学方程式可知需要Cu2S的物质的量是3.2×105 mol。所以日均需精辉铜矿的质量是3.2×105 mol×160 g/mol/(1-23%)=66.5 t;日均生成二氧化硫的物质的量也是3.2×105 mol,标准状况下的体积是3.2×105 mol×22.4 L/mol=7.17×106 L;(3)根据题意,剩余不溶物只能是Cu,不可能含有Fe;若存在Fe,则溶液中的铜离子被全部置换出,则不溶物的质量大于11.2 g;4.8 g Cu的物质的量是0.075 mol,开始加入Cu的物质的量是11.2 g/64 g/mol=0.175 mol,所以相当于溶解Cu 0.1 mol,Fe的物质的量是11.2 g/56 g/mol=0.2 mol,则此过程中共失去电子的物质的量是(0.2+0.1) mol×2=0.6 mol,根据得失电子守恒,则铁离子的物质的量是0.6 mol,所以氯化铁溶液的物质的量浓度是0.6 mol/0.2 L=3.0 mol/L;(4)根据题意,Cu与氢离子、硫酸根离子反应生成铜离子、氮的氧化物、水,氯离子不参加反应,反应前n(HNO3)=0.2175 mol,n(HCl)=0.3 mol,n(Cu)=5.12 g/64 g/mol=0.08 mol,所以剩余硝酸根量少于氯离子,且Cu(NO3)2·3H2O溶解度大,则析出的是CuCl2晶体;无水氯化铜的溶解度是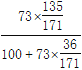 ×100=50.0 g;设晶体化学式为CuCl2·xH2O,反应生成氯化铜的质量是0.08 mol×135 g/mol=10.8 g,剩余水的质量是54.32 g-42 g=12.32 g,析出晶体后剩余溶液为氯化铜的饱和溶液,则
×100=50.0 g;设晶体化学式为CuCl2·xH2O,反应生成氯化铜的质量是0.08 mol×135 g/mol=10.8 g,剩余水的质量是54.32 g-42 g=12.32 g,析出晶体后剩余溶液为氯化铜的饱和溶液,则 =
=![]() ,解得x=3,该晶体的化学式为CuCl2·3H2O。
,解得x=3,该晶体的化学式为CuCl2·3H2O。

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案