题目内容
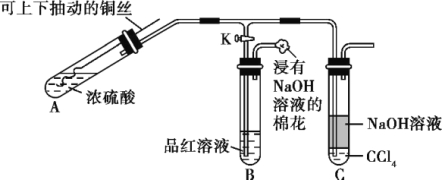
【题目】某化学课外兴趣小组用下图所示装置探究铜跟浓硫酸的反应情况。
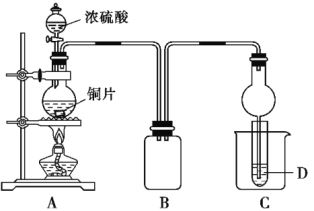
(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请在图上把导管补充完整。
(2)实验中他们取6.4 g 铜片和12 mL 18 mol·![]() 浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①写出铜跟浓硫酸反应的化学方程式: ;
②有一定量的余酸但未能使铜片完全溶解,你认为原因是 ;
(3)为定量测定余酸的物质的量浓度,该小组学生进行了如下设计:
先测定铜与浓硫酸反应产生的SO2的量,再计算余酸的物质的量浓度。他们认为测定二氧化硫的量的方法有多种,你认为下列实验方案中可行的是 (填写编号,仅有一个正确)。
A.将装置A产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,结束反应后再次称量
B.将装置A产生的气体缓缓通入足量用稀硫酸酸化的高锰酸钾溶液,再加入足量氯化钡溶液,过滤、洗涤、干燥、称量沉淀
C.用排水法测定装置A产生气体的体积(已折算成标准状况)
D.将装置A产生的气体缓缓通入足量氢氧化钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀
E.将装置A产生的气体缓缓通入足量硝酸酸化的硝酸钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀
请你从不可行的方案中选出一例进行分析:
[要求标明不可行的方案序号,说出不可行的理由及造成的误差(偏高或偏低)]。
(4)请你再设计一种其他可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算) 。
【答案】(1)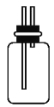
(2)①Cu + 2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
②随着反应进行,硫酸被消耗,浓硫酸变成稀硫酸,稀硫酸和铜不反应
(3)E
方案序号 | 分析 | 误差(偏高或偏低) |
A | 碱石灰除吸收二氧化硫外还能吸收水,测得二氧化硫质量增大 | 偏低 |
B | 高锰酸钾溶液中含有硫酸,与氯化钡反应生成沉淀质量增大 | 偏低 |
C | 二氧化硫在水中溶解,收集到的二氧化硫体积减小 | 偏高 |
D | 亚硫酸钡在空气中烘干及称重过程中部分被氧化生成硫酸钡,使固体质量增大 | 偏低 |
(4)方案一:①取反应后溶液,向其中加入足量锌;②收集并测定氢气的体积;③通过氢气体积计算剩余硫酸的物质的量浓度
方案二:①取反应后溶液,向其中加入过量的氢氧化钠溶液,至氢氧化铜完全沉淀;②过滤、洗涤、(低温)干燥、称量至恒重;③根据氢氧化铜的量计算出已反应的硫酸的量,进而计算剩余硫酸的物质的量浓度
方案三:反应结束后将烧瓶中的铜片取出,洗净、烘干、称其质量,根据其质量计算已反应的硫酸的量,进而计算余酸的物质的量浓度(合理方案均可)
【解析】(1)SO2密度大于空气,收集时应该长进短出。
(2)①铜跟浓硫酸反应的化学方程式为Cu + 2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;②有一定量的余酸但未能使铜片完全溶解,原因是随着反应进行,浓硫酸变成稀硫酸,稀硫酸和铜不反应。
CuSO4+SO2↑+2H2O;②有一定量的余酸但未能使铜片完全溶解,原因是随着反应进行,浓硫酸变成稀硫酸,稀硫酸和铜不反应。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案