题目内容
【题目】【上海市嘉定区2017届高三第二学期教学质量调研考试】氨气是一种重要的化工原料,氨态氮肥是常用的肥料。
工业合成氨的化学方程式:N2 + 3H2![]() 2NH3 +92.4KJ
2NH3 +92.4KJ
(1)它是氮的固定的一种,属于_____________( 选填“大气固氮”、“生物固氮” “人工固氮”);若升高温度,该平衡向____________方向移动(选填“正反应”或“逆反应”)。
(2)该反应达到平衡状态的标志是______________。(选填编号)
a.压强不变 b.v正(H2)= v正(NH3) c.c (N2)不变 d.c(NH3)= c(N2)
(3)欲使NH3产率增大,可采取的措施有_____________、____________。若容器容积为2L,开始加入的N2为0.1mol,20s后测得NH3的物质的量为0.08mol,则N2的平均反应速率为_______________mol/(LS)。
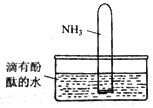
(4)如右图所示,将集有氨气的试管倒置于水槽中,观察到试管内液面上升,溶液变为红色,解释发生该现象的原因____________________________________。
(5)(NH4)2SO4是常用的氮肥,长期施用时会使土壤酸化板结,
用离子方程式表示原因___________________________________
检验(NH4)2SO4含NH4+的方法是_______________________________。
____________________________.
【答案】人工固氮 逆反应 a c 加压,分离氨(合理即给分) 0.001 氨气易溶于水,试管内压强减小,液面上升 生成一水合氨,电离出OH-,溶液呈碱性,故溶液变为红色。或NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH- ,NH3易溶于水,试管内压强减小,液面上升 电离出OH-,溶液呈碱性,故溶液变为红色。(合理即给分) NH4++H2O
NH4++OH- ,NH3易溶于水,试管内压强减小,液面上升 电离出OH-,溶液呈碱性,故溶液变为红色。(合理即给分) NH4++H2O![]() NH3·H2O+H+ 取样,滴加过量浓NaOH溶液后加热,若产生的气体能使湿润的红色石蕊试纸变蓝,说明有NH4+。
NH3·H2O+H+ 取样,滴加过量浓NaOH溶液后加热,若产生的气体能使湿润的红色石蕊试纸变蓝,说明有NH4+。
【解析】(1)工业合成氨属于人工固氮;正方应放热,若升高温度,该平衡向逆反应方向移动;(2)a.正反应体积减小,压强不变说明达到平衡状态,a正确;b.v正(H2)=v正(NH3)均表示正反应速率,反应没有达到平衡状态,b错误;c.c(N2)不变说明达到平衡状态,c正确;d.c(NH3)= c(N2)不能说明正逆反应速率相等,不一定处于平衡状态,d错误,答案ac;(3)正反应体积减小,反应放热,因此欲使NH3产率增大,可采取的措施有加压,分离氨。若容器容积为2L,开始加入的N2为0.1mol,20s后测得NH3的物质的量为0.08mol,则消耗氮气是0.04mol,因此N2的平均反应速率为![]() =0.001mol/(Ls)。(4)由于氨气易溶于水,试管内压强减小,液面上升。生成一水合氨,电离出OH-,溶液呈碱性,因此溶液变为红色。(5)铵根水解显酸性,所以长期施用时会使土壤酸化板结,离子方程式为NH4++H2O
=0.001mol/(Ls)。(4)由于氨气易溶于水,试管内压强减小,液面上升。生成一水合氨,电离出OH-,溶液呈碱性,因此溶液变为红色。(5)铵根水解显酸性,所以长期施用时会使土壤酸化板结,离子方程式为NH4++H2O![]() NH3·H2O+H+。铵根能与强碱反应生成碱性气体氨气,则检验(NH4)2SO4含NH4+的方法是取样,滴加过量浓NaOH溶液后加热,若产生的气体能使湿润的红色石蕊试纸变蓝,说明有NH4+。
NH3·H2O+H+。铵根能与强碱反应生成碱性气体氨气,则检验(NH4)2SO4含NH4+的方法是取样,滴加过量浓NaOH溶液后加热,若产生的气体能使湿润的红色石蕊试纸变蓝,说明有NH4+。
【名师点评】:该题的难点是平衡状态判断,可逆反应达到平衡状态有两个核心的判断依据:①正反应速率和逆反应速率相等。②反应混合物中各组成成分的百分含量保持不变。只要抓住这两个特征就可确定反应是否达到平衡状态,对于随反应的发生而发生变化的物理量如果不变了,即说明可逆反应达到了平衡状态。判断化学反应是否达到平衡状态,关键是看给定的条件能否推出参与反应的任一物质的物质的量不再发生变化。