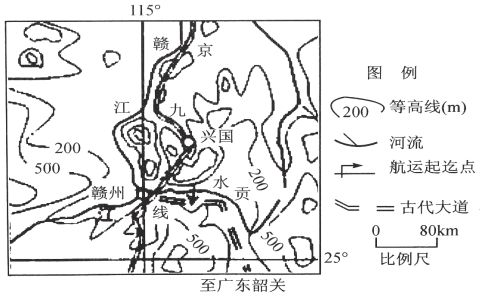
题目内容
【题目】某pH=1的溶液X,其中可能含有Al3+、Ba2+、![]() 、Fe2+、Fe3+、
、Fe2+、Fe3+、![]() 、
、![]() 、
、![]() 、
、![]() 中的一种或几种,取200 mL该溶液进行实验,其现象及转化如图。
中的一种或几种,取200 mL该溶液进行实验,其现象及转化如图。
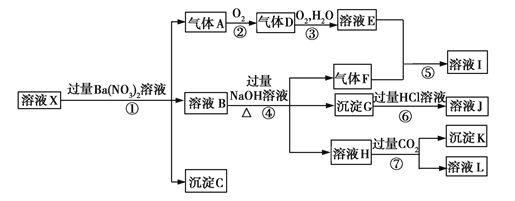
已知:反应过程中有一种气体是红棕色。
请回答下列问题:
(1)仅由强酸性条件便可判断溶液X中一定不存在的离子有 。
(2)溶液X中,关于![]() 的判断一定正确的是 (填字母)。
的判断一定正确的是 (填字母)。
a.一定有 b.一定没有 c.可能有
(3)①中产生气体A的离子方程式为 。
(4)⑦中生成沉淀K的离子方程式为 。
(5)溶液X中不能确定的离子是 ,用实验证明该离子一定不存在的化学方法为 。
(6)若实验测定A、F、K均为0.01 mol,试确定沉淀C及其物质的量范围: 。
【答案】(12分)
(1)![]() 、
、![]() (2分)
(2分)
(2)b(1分)
(3)3Fe2++4H++![]()
![]() 3Fe3++NO↑+2H2O(2分)
3Fe3++NO↑+2H2O(2分)
(4)![]() +CO2+2H2O
+CO2+2H2O![]() Al(OH)3↓+
Al(OH)3↓+![]() (2分)
(2分)
(5)Fe3+(1分) 取少量溶液X于试管中,加入几滴KSCN溶液,溶液不变红色,说明无Fe3+(其他答案合理也可)(2分)
(6)n(BaSO4)≥0.06 mol(2分)
【解析】由反应①加入的Ba(NO3)2溶液及pH=1,结合溶液中可能含有的离子等信息可判断气体A为NO,气体D为NO2,溶液E为HNO3,因此溶液中含有还原性的离子,即含有Fe2+,不含![]() ;由反应④加入过量NaOH溶液及溶液中可能存在的离子判断气体F为NH3,溶液I为NH4NO3,溶液中含有
;由反应④加入过量NaOH溶液及溶液中可能存在的离子判断气体F为NH3,溶液I为NH4NO3,溶液中含有![]() ;pH=1的溶液中不可能含有
;pH=1的溶液中不可能含有![]() 、
、![]() ,故沉淀C为BaSO4;根据图示关系及可能存在的离子可知沉淀G为Fe(OH)3,溶液J为FeCl3;沉淀K为Al(OH)3。(5)生成Fe(OH)3的Fe3+可能来自于Fe2+被硝酸氧化,也可能是原来溶液中就存在Fe3+,故不能确定溶液X中是否存在Fe3+,可用KSCN溶液检验溶液X中是否存在Fe3+。(6)NO、NH3、Al(OH)3各为 0.01 mol,则说明溶液X中有0.03 mol Fe2+、0.01 mol
,故沉淀C为BaSO4;根据图示关系及可能存在的离子可知沉淀G为Fe(OH)3,溶液J为FeCl3;沉淀K为Al(OH)3。(5)生成Fe(OH)3的Fe3+可能来自于Fe2+被硝酸氧化,也可能是原来溶液中就存在Fe3+,故不能确定溶液X中是否存在Fe3+,可用KSCN溶液检验溶液X中是否存在Fe3+。(6)NO、NH3、Al(OH)3各为 0.01 mol,则说明溶液X中有0.03 mol Fe2+、0.01 mol ![]() 、0.01 mol Al3+。若溶液X中不存在Fe3+,由上述推断可知溶液中一定存在Al3+、
、0.01 mol Al3+。若溶液X中不存在Fe3+,由上述推断可知溶液中一定存在Al3+、![]() 、Fe2+、
、Fe2+、![]() ,由溶液中的电荷守恒可知3n(Al3+)+n(
,由溶液中的电荷守恒可知3n(Al3+)+n(![]() )+2n(Fe2+)+n(H+)=2n(
)+2n(Fe2+)+n(H+)=2n(![]() ),故n(
),故n(![]() )=
)=![]() (0.03 mol+0.01 mol+0.06 mol+0.02 mol)=0.06 mol,若溶液中含有Fe3+,则n(
(0.03 mol+0.01 mol+0.06 mol+0.02 mol)=0.06 mol,若溶液中含有Fe3+,则n(![]() )>0.06 mol。
)>0.06 mol。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案