题目内容
【题目】常温下,取一定量的PbI2固体配成饱和溶液,t时刻改变某一条件,离子的浓度变化如图所示[注:第一次平衡时c(I)=2×103 mol·L1,c(Pb2+)=1×103 mol·L1]。下列有关说法正确的是
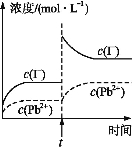
A.常温下PbI2的Ksp=2×106
B.温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,PbI2的溶解度不变,c(Pb2+)增大
C.t时刻改变的条件可能是升高温度,PbI2的Ksp增大
D.常温下Ksp(PbS)=8×1028,向PbI2的悬浊液中加入Na2S溶液,PbI2(s)+S2(aq)![]() PbS(s)+2I(aq)反应的化学平衡常数为5×1018
PbS(s)+2I(aq)反应的化学平衡常数为5×1018
【答案】D
【解析】Ksp=c(Pb2+)·c2(I)=4×109,A错误;加入硝酸铅,c(Pb2+)增大,PbI2的溶解度减小,B错误;t时刻时c(I)增加、c(Pb2+)不变,所以改变的条件不可能是升高温度,C错误;K=![]() ,D正确。
,D正确。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目