题目内容
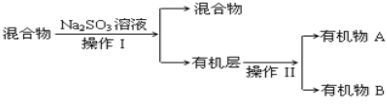
【题目】已知:CH3Cl常温下为气态,难溶于水,易溶于乙醇等有机溶剂,实验室制备CH3Cl原理为:CH3OH+HCl(浓) ![]() CH3Cl(g)+H2O
CH3Cl(g)+H2O
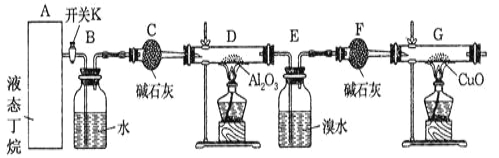
(1)实验步骤如下:
①干燥ZnCl2晶体。实验室干燥ZnCl2晶体制得无水ZnCl2的方法是____。
②称取13.6g研细的无水ZnCl2,量取20mL浓盐酸、一定量的CH3OH,分别放入装置______(填装置编号)的对应仪器中;
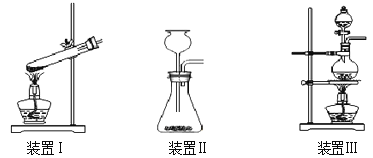
③产生的CH3Cl气体,最好选用排水法收集,原因是___________。
(2)为探究CH3Cl与CH4分子稳定性的差别,某化学兴趣小组设计实验验证CH3Cl能被强氧化剂酸性高锰酸钾溶液氧化。
①将CH3Cl制备装置中产生的气体依次通过以下三个洗气瓶______(按顺序填洗气瓶编号),如果观察到A中紫色褪去的实验现象则证明CH3Cl稳定性弱于CH4。
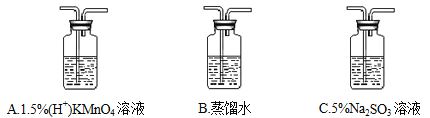
②实验过程中发现,洗气瓶A中紫色褪去了,并产生一种黄绿色气体和一种无色气体,则其发生反应的离子方程式:_________; 洗气瓶C中发生反应的离子方程式:____________。
③为处理未反应完的CH3Cl,还应在上述洗气瓶后接一只盛_________(填试剂名称)的洗气瓶。
【答案】(1)①在干燥的HC1气氛中加热 ②Ⅲ ③CH3C1不易溶于水,用排水法收集同时可除去HC1、CH3OH等杂质气体(2) ①BAC ②10CH3Cl+14MnO4—+42H+=14Mn2++10CO2↑+5Cl2↑+36H2O SO32—+C12+H2O=SO42—+2Cl—+2H+ ③乙醇
【解析】(1)①ZnCl2为强酸弱碱盐,在加热ZnCl2晶体时可选择通HCl气体抑制其水解;
②制备原理是液体与液体加热,因此需要装置Ⅲ。
③因CH3Cl中混有易溶于水的杂质气体,用排水法可以可除去HCl、CH3OH等杂质气体。
(2)①如果CH3Cl能被强氧化剂酸性高锰酸钾氧化,可选择先通过盛有水的洗气瓶除去可能混合有的HCl和甲醇,再通过盛有的酸性高锰酸钾洗气瓶,溶液的紫色会褐去,最后通过盛Na2SO3的洗气瓶吸收生成的氯气防污染;
②酸性高锰酸钾氧化CH3Cl会生成CO2和Cl2,同时自身被还原成Mn2+,发生反应的离子方程式为10CH3Cl+14MnO4-+42H+=14Mn2++10CO2↑+5Cl2↑+36H2O,生成的氯气经过Na2SO3的洗气瓶会氧化Na2SO3为Na2SO4,发生反应的离子方程式为SO32-+C12+H2O=SO42-+2Cl-+2H+ ;
③CH3Cl易溶于乙醇和丙醇等有机溶剂,可选择酒精吸收CH3Cl的尾气。

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案