题目内容
【题目】【2017辽宁模拟】已知:2CrO42﹣+2H+Cr2O72﹣+H2O.25℃时,调节初始浓度为1.0molL﹣1 的Na2CrO4溶液的pH,测定平衡时溶液中c(Cr2O72﹣)和c(H+),获得如图所示的曲线.下列说法不正确的是( )
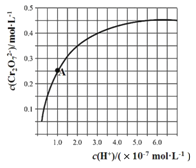
A.平衡时,pH越小,c(Cr2O72﹣)越大
B.A点CrO42﹣的平衡转化率为50%
C.A点CrO42﹣转化为Cr2O72﹣反应的平衡常数K=1014
D.平衡时,若溶液中c(Cr2O72﹣)=c(Cr2O42﹣),则c(H+)>2.0×10﹣7 molL﹣1
【答案】D
【解析】A.由图可知氢离子浓度越大,c(Cr2O72﹣)越大,所以pH越小,c(Cr2O72﹣)越大,故A正确;B.由图可知A点时Cr2O72﹣的平衡浓度为0.25mol/L,所以转化的CrO42﹣的浓度为:0.5mol/L,则A点CrO42﹣的平衡转化率为50%,故B正确;C.2CrO42﹣+2H+![]() Cr2O72﹣+H2O的平衡常数为:K=
Cr2O72﹣+H2O的平衡常数为:K= =
=![]() =1014,故C正确;D.平衡时,若溶液中c(Cr2O72﹣)=c(CrO42﹣),而2c(Cr2O72﹣)+c(CrO42﹣)=1.0molL﹣1,所以c(Cr2O72﹣)=
=1014,故C正确;D.平衡时,若溶液中c(Cr2O72﹣)=c(CrO42﹣),而2c(Cr2O72﹣)+c(CrO42﹣)=1.0molL﹣1,所以c(Cr2O72﹣)=![]() molL﹣1,而图中c(Cr2O72﹣)=0.35mol/L时,对应氢离子的浓度为2.0×10﹣7 molL﹣1,则溶液中c(Cr2O72﹣)=c(Cr2O42﹣),则c(H+)<2.0×10﹣7 molL﹣1,故D错误;故选D。
molL﹣1,而图中c(Cr2O72﹣)=0.35mol/L时,对应氢离子的浓度为2.0×10﹣7 molL﹣1,则溶液中c(Cr2O72﹣)=c(Cr2O42﹣),则c(H+)<2.0×10﹣7 molL﹣1,故D错误;故选D。

练习册系列答案
相关题目