题目内容
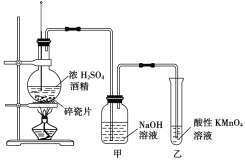
【题目】如图是某同学设计的制取氯气以及验证氯气的性质的实验,回答下列问题

(1)该同学制取氯气的反应原理是: (写化学方程式)。
(2)实验过程中②处观察到的现象是 说明氯气具有的性质是 。
(3)该实验操作的不足之处是
(4)实验室用MnO2和浓盐酸制取Cl2时,有14.6 g氯化氢被氧化,所得Cl2全部用NaOH溶液吸收,生成NaClO的物质的量是 moi
【答案】(1)MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)棉花变蓝,氧化性
(3)缺少尾气吸收装置(4)0.1 mol
【解析】(1)该同学用浓盐酸和二氧化锰反应制取氯气,反应原理是MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)实验过程中②处的KI会和氯气反应置换出I2,会观察到棉花变蓝,说明氯气具有氧化性;
(3)由于氯气是有毒气体,所以该实验操作的不足之处是缺少尾气吸收装置;
(4)14.6 g氯化氢的物质的量是14.6/36.5=0.4mol,则生成氯气的物质的量是0.1mol,用NaOH溶液吸收,发生反应2NaOH+ Cl2=NaCl+ NaClO+ H2O,则生成NaClO的物质的量是0.1 mol。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】实验探究是体验知识的产生和形成过程的基本途径。下面是某同学完成的探究实验报告的一部分:
实验名称:卤素单质的氧化性强弱比较
实验药品:KBr溶液、KI溶液、氯水、溴水、碘水、四氯化碳、淀粉碘化钾试纸
实验设计如下表:
实验步骤 | 实验结论 |
①新制氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 | |
②NaBr溶液+新制氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 | 氧化性从强到弱的顺序:氯、溴、碘 |
③KI溶液+新制氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 |
请回答下列问题:
(1)完成该实验需用到的实验仪器是 、 。(填仪器名称)
(2)步骤②中反应的化学方程式为 ,步骤③中反应的离子方程式为 。
(3)CCl4在实验中所起的作用是 。
(4)该同学的实验设计不足之处是 ,改进的办法是 。