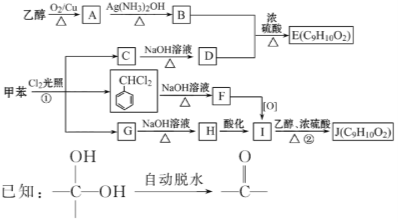
题目内容
【题目】室温下,用0.l00mol/L NaOH溶液分别滴定20.00 mL 0.100 mol/L的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是
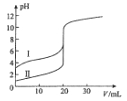
A.II表示的是滴定醋酸的曲线
B.pH=7时,滴定醋酸消耗的V(NaOH)小于20 mL
C.V(NaOH)= 20.00 mL时,两份溶液中c(Cl-)= C(CH3COO-)
D.V(NaOH) =10.00 mL时,醋酸溶液中c(Na+)> C(CH3COO-)> c(H+)> c(OH-)
【答案】B
【解析】解答本题,首先应该掌握物质酸的相对强弱,了解在浓度相同时电离产生的离子浓度的大小。然后看其与与碱混合发生反应时,酸碱相对物质的量的多少、溶液中的溶质的种类、电解质的电离程度与产生的盐的水解程度的相对大小。最后对选项中的问题根据题意进行解答。A.相同浓度的盐酸和醋酸,由于盐酸是一元强酸,在水溶液中完全电离,醋酸是一元弱酸,在水溶液中部分电离。所以溶液的pH醋酸的大,盐酸小。因此I表示的是醋酸,II表示的是盐酸。错误。B.NaOH是强碱,HCl是强酸,当pH=7时,二者恰好反应,物质的量相等,所以n(NaOH)=20ml。若与醋酸反应的NaOH的体积也是20ml.则得到的是醋酸钠。醋酸钠是强碱弱酸盐,水解是溶液显碱性,因此若要使pH=7时,则滴加的体积就要少于20ml。因此滴定消耗的V(NaOH),酸小醋于20 mL。正确。C.任何溶液都符合电荷守恒。、质子守恒、物料守恒。在醋酸溶液中加入20mlNaOH溶液时,醋酸根离子会发生水解反应,所以除了存在醋酸分子外,还存在醋酸根离子。根据物料守恒,可得c(Cl-)=c(Na+)= C(CH3COO-)+ C(CH3COOH)。错误。D. V(NaOH) =10.00 mL时,得到是醋酸和醋酸钠等浓度的混合溶液。由于在等浓度、等体积的醋酸与醋酸钠的混合溶液中,醋酸分子的电离作用大于醋酸钠盐的水解作用,所以根据物料守恒和电荷守恒可得:溶液中C(CH3COO-)>c(Na+)> c(H+)> c(OH-)。错误。