题目内容
【题目】已知Ba(AlO2)2可溶于水。如图表示的是向100 mL 0.02 mol·L1 KAl(SO4)2溶液中逐滴加入0.05 mol·L1的Ba(OH)2溶液时(25 ℃),生成沉淀的物质的量与加入Ba(OH)2溶液的体积的关系。下列说法不正确的是
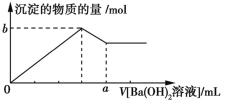
A.所加的Ba(OH)2溶液的pH=13
B.b点是0.005 mol
C.a点是80 mL
D.当V[Ba(OH)2溶液]=30 mL时,生成沉淀的质量是0.699 g
【答案】D
【解析】0.05 mol·L1 Ba(OH)2溶液中c(OH)=0.1 mol·L1,pH为13,A项正确;b点时,Al3+完全沉淀,发生反应的方程式为2KAl(SO4)2+3Ba(OH)2![]() 2Al(OH)3↓+3BaSO4↓+K2SO4,根据方程式可知生成的Al(OH)3为0.002 mol,BaSO4为0.003 mol,生成的沉淀共0.005 mol,B项正确;a点时,Al3+全部转化为
2Al(OH)3↓+3BaSO4↓+K2SO4,根据方程式可知生成的Al(OH)3为0.002 mol,BaSO4为0.003 mol,生成的沉淀共0.005 mol,B项正确;a点时,Al3+全部转化为![]() ,化学方程式为KAl(SO4)2+2Ba(OH)2
,化学方程式为KAl(SO4)2+2Ba(OH)2![]() KAlO2+2BaSO4↓+2H2O,消耗Ba(OH)2溶液的体积为
KAlO2+2BaSO4↓+2H2O,消耗Ba(OH)2溶液的体积为 ![]() =80(mL),C项正确;当V[Ba(OH)2溶液]=30 mL时,Ba(OH)2的物质的量为1.5×103 mol,生成Al(OH)3的物质的量为1×103 mol,即0.078 g,BaSO4为1.5×103 mol,即0.349 5 g,生成的沉淀共计0.427 5 g,D项不正确。
=80(mL),C项正确;当V[Ba(OH)2溶液]=30 mL时,Ba(OH)2的物质的量为1.5×103 mol,生成Al(OH)3的物质的量为1×103 mol,即0.078 g,BaSO4为1.5×103 mol,即0.349 5 g,生成的沉淀共计0.427 5 g,D项不正确。

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目