题目内容
【题目】天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠泄漏,可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻环境污染.
资料:氰化钠化学式NaCN(C元素+2价,N元素﹣3价),白色结晶颗粒,剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢.
I、(1)NaCN水溶液呈碱性,其原因是____________(用离子方程式解释).
(2)双氧水氧化法除NaCN:碱性条件下加入H2O2,可得到纯碱和一种无色无味的无毒气体,该反应的离子方程式为____________________________.
(3)非金属性N______C(填“<”、“>”或“=”),请设计实验证明:_____________。
II、某化学兴趣小组实验室制备硫代硫酸钠(Na2S2O3),并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放.
[实验一]实验室通过如图装置制备Na2S2O3.
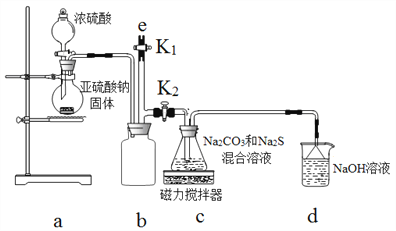
(4)b装置的作用是_______________.
(5)c装置中的产物有Na2S2O3和CO2等,d装置中的溶质有NaOH、Na2CO3,还可能有__.
(6)实验结束后,在e处最好连接盛__(选填“NaOH溶液”、“水”、“CCl4”中任一种)的注射器,再关闭K2打开K1防止拆除装置时污染空气.
[实验二]测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量.
己知:①废水中氰化钠的最高排放标准为0.50mg/L.
②Ag++2CN—=[Ag(CN)2] —,Ag++I—=AgI↓,AgI呈黄色,且CN —优先与Ag+反应.
实验如下.取25.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.000×10﹣4mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为2.50mL.
(7)滴定终点的判断方法是_______________.
(8)处理后的废水中氰化钠的含量为_______________mg/L.
【答案】I、(1)CN-+H2O![]() HCN+OH-(2)2CN-+5H2O2+2 OH-=2CO32-+N2↑+6H2O
HCN+OH-(2)2CN-+5H2O2+2 OH-=2CO32-+N2↑+6H2O
(3)> 取少量碳酸氢钠于试管中,加入稀硝酸,有无色气泡产生,说明酸性硝酸大于碳酸,则非金属性N>C (4)安全瓶,防止倒吸(5)Na2SO3(6)NaOH溶液(7)滴入最后一滴硝酸银溶液,出现淡黄色沉淀(8)0.98
【解析】本题为化学实验综合题,为高考必考题。考查化学实验方案的分析、评价和设计,物质的制备和含量的测定。
I、(1)NaCN是强碱弱酸盐,溶于水,CN-离子水解生成OH-,显碱性,离子方程式为CN-+H2O![]() HCN+OH-;(2)根据题给信息知碱性条件下,NaCN与H2O2反应纯碱和氮气,利用化合价升降法结合原子守恒、电荷守恒配平,该反应的离子方程式为2CN-+5H2O2+2 OH-=2CO32-+N2↑+6H2O;(3)非金属性N>C,可通过比较最高价氧化物水化物的酸性强弱来判断,实验方案为取少量碳酸氢钠于试管中,加入稀硝酸,有无色气泡产生,说明酸性硝酸大于碳酸,则非金属性N>C。
HCN+OH-;(2)根据题给信息知碱性条件下,NaCN与H2O2反应纯碱和氮气,利用化合价升降法结合原子守恒、电荷守恒配平,该反应的离子方程式为2CN-+5H2O2+2 OH-=2CO32-+N2↑+6H2O;(3)非金属性N>C,可通过比较最高价氧化物水化物的酸性强弱来判断,实验方案为取少量碳酸氢钠于试管中,加入稀硝酸,有无色气泡产生,说明酸性硝酸大于碳酸,则非金属性N>C。
II、[实验一]实验室装置制备Na2S2O3。a装置制备二氧化硫,c装置中制备Na2S2O3,反应导致装置内气压减小,b为安全瓶作用,防止溶液倒吸,d装置吸收多余的二氧化硫,防止污染空气。(4)b装置的作用是安全瓶,防止倒吸;(5)d装置吸收二氧化硫,d中溶质有NaOH、Na2CO3,碱过量,还有Na2SO3生成;(6)实验结束后,装置b中还有残留的二氧化硫,为防止污染空气,应用氢氧化钠溶液吸收。
[实验二](7)根据信息②Ag++2CN—=[Ag(CN)2] —,Ag++I—=AgI↓,AgI呈黄色,且CN —优先与Ag+反应知Ag+与CN-反应生成[Ag(CN)2]-,当CN-反应结束时,Ag+与I-生成AgI黄色沉淀,说明反应到达滴定终点,滴定终点的判断方法是滴入最后一滴硝酸银溶液,出现淡黄色沉淀;(8)消耗AgNO3的物质的量为:2.5×10-3L×0.0001mol/L=2.50×10-7mol,根据方程式Ag++2CN—=[Ag(CN)2] —,处理的废水中氰化钠的质量为5.00×10-7mol×49g/mol=2.45×10-5g,废水中氰化钠的含量为2.45×10-5mg÷0.025L=0.98mg/L。