题目内容
【题目】A、B、C、D分别由下面括号中的粒子结合而成(阳离子:![]() 、Na+、H+;阴离子:Cl、OH、
、Na+、H+;阴离子:Cl、OH、![]() ,可重复选择),它们均能抑制水的电离。常温下将一定浓度的各溶液从1 mL稀释到1 000 mL,pH变化如图Ⅰ所示。请回答:
,可重复选择),它们均能抑制水的电离。常温下将一定浓度的各溶液从1 mL稀释到1 000 mL,pH变化如图Ⅰ所示。请回答:
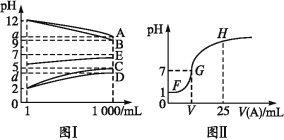
(1)根据图Ⅰ的pH变化关系写出化学式:A ,C![]() 。
。
(2)等体积、等物质的量浓度的B溶液与D溶液反应生成E,E溶液显酸性,其原因是 。
(3)图Ⅱ是室温时向25 mL某浓度的C溶液中逐渐滴加0.25 mol·L1 A溶液时pH的变化曲线。G点呈中性,此时,V 10 mL(填“=”“>”或“<”)。
【答案】(8分,每空2分)
(1)NH3·H2O HCl
(2)![]() 的电离程度大于其水解程度(合理解释均可)
的电离程度大于其水解程度(合理解释均可)
(3)>
【解析】由A、B、C、D均能抑制水的电离,可知A、B、C、D是酸或碱,只能为NH3·H2O、NaOH、HCl、H2SO3,由图Ⅰ可知A、B为碱,且B为强碱,C、D为酸,且C为强酸,所以A、B、C、D分别为NH3·H2O、NaOH、HCl、H2SO3,E为NaHSO3;
(3)由起点pH=1可知c(HCl)=0.1 mol·L1,V=10 mL时,恰好中和生成NH4Cl,溶液显酸性,应该再多加入氨水溶液才能显中性,所以V>10 mL。

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案
相关题目