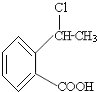
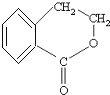
题目内容
【题目】已知:A、B、C、D四种元素,原子序数依次增大。A是短周期元素中金属性最强的元素,B元素3p能级半充满;C是所在周期电负性最大的元素;D是第四周期未成对电子最多的元素。试回答下列有关问题:
(1)写出D元素价电子的电子排布式___________。
(2)D可形成化合物[D(H2O)6](NO3)3。
①[D(H2O)6](NO3)3中阴离子的立体构型是_________。![]() 中心原子的轨道杂化类型为 。
中心原子的轨道杂化类型为 。
②在[D(H2O)6]3+中D3+与H2O之间形成的化学键称为_________,1 mol [D(H2O)6] 3+中含有的σ键有 mol。
(3)已知B、C两种元素形成的化合物通常有两种。这两种化合物中 (填化学式)为非极性分子。另一种物质的电子式为 。
(4)由A、C两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。如下图所示为A、C形成化合物的晶胞结构图以及晶胞的剖面图:

晶胞中距离一个A+最近的C有______个,这些C围成的图形是________;若晶体密度为ρ g·cm3,阿伏加德罗常数的值用NA表示,则A+的离子半径为_______cm(用含NA与ρ的式子表达)。
【答案】(1)3d54s1
(2)①平面三角形 sp2杂化 ②配位键 18
(3)PCl5 ![]()
(4)6 正八面体 
【解析】A是短周期中原子半径最大的元素,则A为钠元素;B元素3p能级半充满且原子序数比A大,则B为磷元素;D是第四周期未成对电子最多的元素,则D的电子排布为[Ar]3d54s1,该元素为铬;C只能位于第三周期,该周期电负性最大的元素是氯元素。
(1)D为铬元素,其价电子排布为3d54s1。
(2)①![]() 中心原子氮原子的价电子对数为
中心原子氮原子的价电子对数为![]() =3,所以N原子为sp2杂化轨道,对应的立体构型是平面三角形。②在[Cr(H2O)6]3+中Cr3+有空的原子轨道,而H2O分子的氧原子有孤对电子,H2O中的孤对电子填充Cr3+的空轨道而形成配位键,[D(H2O)6]3+中6个配位键都是σ键,每个水分子内氧原子与氢原子形成2个σ键,因此1 mol [D(H2O)6] 3+中含有18 mol的σ键。
=3,所以N原子为sp2杂化轨道,对应的立体构型是平面三角形。②在[Cr(H2O)6]3+中Cr3+有空的原子轨道,而H2O分子的氧原子有孤对电子,H2O中的孤对电子填充Cr3+的空轨道而形成配位键,[D(H2O)6]3+中6个配位键都是σ键,每个水分子内氧原子与氢原子形成2个σ键,因此1 mol [D(H2O)6] 3+中含有18 mol的σ键。
(3)B、C形成的两种常见化合物为PCl5和PCl3,其中PCl5分子中磷原子的价电子全部参与成键,没有孤对电子,磷原子与氯原子形成5个共价键,空间构型为三角双锥形,电荷分布对称,正负电荷重心重合,所以是非极性分子。PCl3中磷原子有3个电子与氯原子共用,形成3个共价键,有一对孤对电子,是极性分子,其电子式为:![]() 。
。
(4)A、C两元素形成的化合物为NaCl,从晶胞结构看,黑球半径小代表Na+,白球半径大代表Cl,现选定立方体中心的Na+作为研究对象,则距离该Na+最近的Cl分别位于6个面的面心,这6个Cl围成一个正八面体。晶胞中的1个Na+位于体心,12个Na+分别位于12条棱的中点,根据均摊法可求得该晶胞拥有的Na+数为:1+12×![]() =4;晶胞中6个面的面心各有1个Cl,八个顶点各有一个Cl,同理可求得该晶胞拥有的Cl数为:6×
=4;晶胞中6个面的面心各有1个Cl,八个顶点各有一个Cl,同理可求得该晶胞拥有的Cl数为:6×![]() +8×
+8×![]() =4;设晶胞的边长为a,则由密度公式可得ρ ·a3 = 4×
=4;设晶胞的边长为a,则由密度公式可得ρ ·a3 = 4×![]() ,变形得a=
,变形得a= ,从晶胞截面图得 a=2r++2r(r+、r分别表示Na+和Cl的半径),4r=
,从晶胞截面图得 a=2r++2r(r+、r分别表示Na+和Cl的半径),4r=![]() (4r为截面对角线长度),则r+=
(4r为截面对角线长度),则r+=![]() (a2r)=
(a2r)= 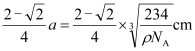 ,此即为所求的Na+半径。
,此即为所求的Na+半径。