题目内容
【题目】硫酸锰可用于饮料营养强氧化剂和媒染剂。其生产原材料软锰矿(MnO2)、菱锰矿(MnCO3)中常混有硫酸亚铁和硫酸镁等杂质,生产工艺流程如图所示:
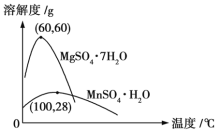
已知:(1)硫酸锰晶体和硫酸镁晶体的溶解度曲线如图所示。
(2)各离子完全沉淀的pH:Fe3+为3.5,Fe2+为9.5,Mn2+为10.8,Mg2+为11.6。
下列判断正确的是
A.试剂A应该选择H2O2,目的是将Fe2+氧化为Fe3+
B.试剂A应该选择氨水,目的是调节溶液的pH
C.操作Ⅰ包括蒸发结晶、冷却结晶、趁热过滤、洗涤等步骤,洗涤时可用稀硫酸作洗涤液
D.通过操作Ⅰ得到MnSO4·H2O的过程中,包括蒸发结晶,在蒸发结晶时,温度应该高于60 ℃
【答案】D
【解析】从生产工艺流程图看,由于最终得到的产物是MnSO4,为了不引入新的杂质,酸浸时所加入的酸应是硫酸。硫酸只能将MnCO3溶解,而MnO2不溶解,但MnO2的氧化性比氯气的强,故MnO2可将Fe2+氧化为Fe3+,自身转化为Mn2+。因此在沉淀池中加入试剂A的目的是调节溶液pH,使Fe3+沉淀,但如果试剂A选择氨水,会引入![]() ,不可行,应是含Mn2+的化合物,可能是MnCO3或Mn(OH)2等,A、B项错误;由于MnSO4·H2O易溶于水,故洗涤时不能用稀硫酸,C项错误;温度高于60 ℃时,MgSO4·7H2O的溶解度减小,故温度应该高于60 ℃,正确。
,不可行,应是含Mn2+的化合物,可能是MnCO3或Mn(OH)2等,A、B项错误;由于MnSO4·H2O易溶于水,故洗涤时不能用稀硫酸,C项错误;温度高于60 ℃时,MgSO4·7H2O的溶解度减小,故温度应该高于60 ℃,正确。

练习册系列答案
相关题目