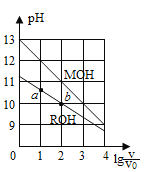
题目内容
【题目】(1)图1表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL, 如果刻度A为4,量简中液体的体积是__________mL。
(2)图II表示50mL滴定管中液画的位置,如果液面处的读数是a ,则滴定管中液体的体积(填代号)________。
A. 是amL B.是(50-a)mL C. 一定大于amL D.一定大于(50-a)mL
(3)排去碱式滴定管中气泡的方法应采用如图所示操作中的____________,(填写“甲”、“乙”、“丙”)然后轻轻挤压玻璃球使尖嘴部分充满碱液。


(4)实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
4NH4++6HCHO=3H++6H2O+(CH2)6N4H+
滴定时,1mol (CH2)6N4H+与1mol H+相当,然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤I:称取样品1.500g。
步骤Ⅱ:将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀。
步骤Ⅲ:移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
A.根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数____________(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积____________(填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察_____________。(填“A”或“B”)
A 滴定管内液面的变化 B 锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由___________色变成___________色。
B.滴定结果如下表所示:
滴定次数 | 待测溶液的 体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 0.20 | 20.20 |
若NaOH标准溶液的浓度为0.1010mo1·L-1,则该样品中氮的质量分数为_______________。
【答案】3.2 D 丙 偏高 无影响 B无 粉红(或浅红)18.85%
【解析】(1)量筒读数至小数点后第一位。
(2) 滴定管零刻度在上方位置,所以液面位置至下方50mL刻度体积为50-a,再下方还有一些液体,所以液体体积一定大于50-a mL。
(3) 排去碱式滴定管中气泡的方法是从玻璃球下方将橡胶管向上弯曲,再挤压玻璃球侧面排出气泡。
(4) ①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则加入的标准溶液会被稀释,因此消耗的NaOH标准溶液偏多,通过计算得到的NH4+物质的量偏大,氮的质量分数结果偏高。
②锥形瓶中蒸馏水不影响实验结果。
③ 滴定时边滴边摇动锥形瓶,眼睛应观察锥形瓶内溶液颜色的变化,溶液的体积是在滴定前后读数相减得到的。
④滴定前溶液呈酸性,加入酚酞溶液无色,终点时溶液接近中性,溶液呈浅红色。
1mol (CH2)6N4H+与1mol H+相当,所以NH4+与NaOH之间为1:1的关系,反应平均消耗NaOH20.00mL,n(NH4+)=n(NaOH)=0.02000×0.1010×10=0.002020mol
氮的质量分数为:0.002020×14×10/1.500=18.85%。

 阅读快车系列答案
阅读快车系列答案