题目内容
【题目】【2017小店区校级模拟】“变化观念与平衡思想”是化学学科的核心素养,室温时0.10mol/L草酸钠溶液中存在多个平衡,其中有关说法正确的是【已知室温时,Ksp(CaC2O4)=2.4×10﹣9】( )
A.若将溶液不断加水稀释,则水的电离程度增大
B.溶液中各离子浓度大小关系c(Na+)>c(C2O42﹣)>c(OH﹣)>c(H+)>c(HC2O4﹣)
C.若用pH计测得溶液的pH=a,则H2C2O4的第二级电离平衡常数Ka2=1013﹣2a
D.向溶液中加入等体积CaCl2溶液,当加入的CaCl2溶液浓度大于2.4×10﹣8mol/L时即能产生沉淀
【答案】C
【解析】A.若向溶液中不断加水稀释,盐类水解程度增大,但水的电离程度减小,故A错误;B.0.10mol/L草酸钠溶液中草酸根离子分步水解溶液显碱性,溶液中离子浓度大小为:c(Na+)>c(C2O42﹣)>c(OH﹣)>c(HC2O4﹣)>c(H+),故B错误;C.若用pH计测得溶液的pH=a,c(OH﹣)=c(HC2O4﹣)=10﹣14+amol/L,C2O42﹣+H2O![]() HC2O4﹣+OH﹣,Kh=
HC2O4﹣+OH﹣,Kh=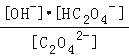 =
=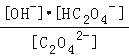 ×
×![]() =
=![]() =
=![]() ,Ka2=1013﹣2a,故C正确;D.ksp(CaC2O4)=c(Ca2+)c(C2O42﹣)=2.4×10﹣9,c(Ca2+)=
,Ka2=1013﹣2a,故C正确;D.ksp(CaC2O4)=c(Ca2+)c(C2O42﹣)=2.4×10﹣9,c(Ca2+)=![]() =4.8×10﹣8mol/L,故D错误;故选C。
=4.8×10﹣8mol/L,故D错误;故选C。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目