题目内容
下列说法正确的是( )| A.25℃时NH4Cl溶液的水的离子积常数Kw大于100℃时NaCl溶液的Kw |
B.SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O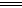 SO32―+2I―+4H+ SO32―+2I―+4H+ |
| C.加入铝粉能产生H2的溶液中,可能存在大量的Na+、Ba2+、AlO2―、NO3- |
| D.100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性 |
C解析:
温度不变,水的离子积不变。SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O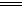 SO4―+2I―+4H+
SO4―+2I―+4H+
25℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性.
温度不变,水的离子积不变。SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O
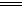 SO4―+2I―+4H+
SO4―+2I―+4H+25℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性.

练习册系列答案
相关题目
在电磁学发展过程中,许多科学家做出了贡献。下列说法正确的是
| A.奥斯特发现了电流磁效应;法拉第发现了电磁感应现象 |
| B.麦克斯韦预言了电磁波;楞次用实验证实了电磁波的存在 |
| C.库仑发现了点电荷的相互作用规律:密立根通过油滴实验测定了元电荷的数值 |
| D.安培发现了磁场对运动电荷的作用规律:洛仑兹发现了磁场对电流的作用规律 |
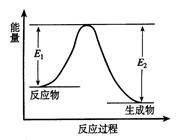
反应A(g)+B(g) C(g) +D(g) 发生过程中的能量变化如图,△H表示反应的焓变。下列说法正确的是( )
C(g) +D(g) 发生过程中的能量变化如图,△H表示反应的焓变。下列说法正确的是( )
 C(g) +D(g) 发生过程中的能量变化如图,△H表示反应的焓变。下列说法正确的是( )
C(g) +D(g) 发生过程中的能量变化如图,△H表示反应的焓变。下列说法正确的是( )
| A.反应体系中加入催化剂,反应速率增大,E1减小,E2增大 |
| B.反应体系中加入催化剂,反应速率增大,△H不变 |
| C.△H < 0,反应达到平衡时,升高温度,A的转化率增大 |
| D.反应达到平衡时,加入A,再次平衡时A的转化率增大 |
如图,A池用石墨电极电解NaOH溶液,B池精炼粗铜,一段时间后停止通电,A池中d极产生具有氧化性的气体在标准状况下为2.24L。下列说法正确的是( )
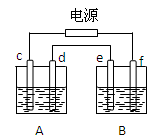

| A.A池为电解池,B池为原电池 |
| B.d、e两极都发生氧化反应 |
| C.e极应为粗铜板材料 |
| D.B池中e极质量增加12.8g |
一定条件下,在体积为2L的密闭容器中,3molX和3mol Y发生反应:3X(g)+Y(g)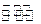 2Z(g),经60s达到平衡,生成0.4mol Z。下列说法正确的是 ( )
2Z(g),经60s达到平衡,生成0.4mol Z。下列说法正确的是 ( )
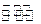 2Z(g),经60s达到平衡,生成0.4mol Z。下列说法正确的是 ( )
2Z(g),经60s达到平衡,生成0.4mol Z。下列说法正确的是 ( )A.60s内反应速率为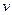 (X)=0.05 mol/(L·s),X的转化率为80% (X)=0.05 mol/(L·s),X的转化率为80% |
B.其它条件不变,将容器体积变为4L,Z的平衡浓度变为原来的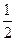 |
| C.其它条件不变,若升高温度,X的体积分数增木,则该反应的△H>0 |
| D.其它条件不变,若初始投入2mol X和2mol Y则物质Y的转化率减小 |