题目内容
同学们都有这样的学习、生活经验:木炭在氧气中燃烧比空气中燃烧得更旺;夏天,将食品放在冰箱里不容易腐烂.说明反应物的浓度和温度对化学反应快慢(反应速率)有影响.那么,浓度和温度是如何影响化学反应速率的?
(1)提出假设:
a.浓度越大,化学反应越快;
b.温度越高,化学反应越快.
(2)设计方案:同学们利用铁粉和盐酸反应来探究上述问题,设计了下列3组实验.
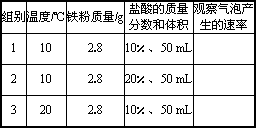
(3)分析探究:将铁粉加入到盛盐酸的烧杯中发生反应,写出反应的化学方程式________.哪两组实验用来探究“温度越高,化学反应越快”的假设?________.
(4)讨论反思:事实上,化学反应的发生,是反应物的微观粒子相互接触、碰撞的结果.请你解释“盐酸浓度越大,与铁粉反应越快”的原因________.
答案:
解析:
解析:
|
(3)Fe+2HCl=FeCl2+H2↑(化学式错不给分,未配平扣1分) 1和3 (4)盐酸浓度越大,反应物的粒子接触、碰撞的机会就越多,反应就越快 |

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
 电学实验:
电学实验: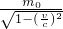 (其中c为光速),根据以上公式我们可以计算出:一个静质量m0=1kg的物体,当它以v1=300m/s和v2=15×104km/s运动时,其动质量分别为:m1=1.000 000 000 0005kg m2=1.15kg,由此可知,物体的动质量比静质量大,且物体的运动速度越大,其动质量越大.从m1值可看出,在低速(相对光速而言)范围内,物体的动质量与静质量相关甚微,其差值可以忽略不计,因此在低速范围内研究宏观物体的运动情况时,可以认为物体的质量是不变的,是常数.但在微观世界里,由于电子、质子等基本粒子的静质量都很小,而其运动速度又很容易接近光速,这时它们的质量随速度的改变就不可忽视,关于这样的问题,同学们将来有机会学习爱因斯坦的”相对论”力学知识时,就会进一步深入理解.请根据刚才的阅读,回答下列问题:
(其中c为光速),根据以上公式我们可以计算出:一个静质量m0=1kg的物体,当它以v1=300m/s和v2=15×104km/s运动时,其动质量分别为:m1=1.000 000 000 0005kg m2=1.15kg,由此可知,物体的动质量比静质量大,且物体的运动速度越大,其动质量越大.从m1值可看出,在低速(相对光速而言)范围内,物体的动质量与静质量相关甚微,其差值可以忽略不计,因此在低速范围内研究宏观物体的运动情况时,可以认为物体的质量是不变的,是常数.但在微观世界里,由于电子、质子等基本粒子的静质量都很小,而其运动速度又很容易接近光速,这时它们的质量随速度的改变就不可忽视,关于这样的问题,同学们将来有机会学习爱因斯坦的”相对论”力学知识时,就会进一步深入理解.请根据刚才的阅读,回答下列问题: