题目内容
某澄清溶液中,可能含有NH4+、Mg2+、Na+、Fe2+、Ag+、OH-、Cl-、I-、NO3-和SO42-等离子中的几种,现进行如下实验:(1)用pH试纸检验时,试纸呈深红色。
(2)取溶液少许,加入足量CCl4,在不断振荡的条件下加入足量氯水,静置,上层接近无色,下层呈紫色。
(3)向(2)所得水溶液中加入AgNO3溶液,有白色沉淀生成。
(4)另取原溶液,调节pH使其呈中性后,滴加NaOH溶液,开始得白色沉淀;接着加入过量NaOH溶液,过滤后给滤液加热,有刺激性气味的气体产生。
(一)由此判断原溶液中一定有大量的 离子。
(二)判断有无I-所应用的反应的离子方程式是
(三)判断有无Mg2+所应用的反应的离子方程式是
(四)在不能确定的离子中,如何检验其中的阳离子?写出试验名称及判断依据的现象。
(每空2分,共10分)
(一)NH4+、Mg2+、I-;-
(二)2I-+Cl2=2Cl-+I2 (三)Mg2++2OH-=Mg(OH)2↓
(四)焰色反应(2分),观察是否有黄色火焰。(2分)解析:
(1)用pH试纸检验时,试纸呈深红色,说明溶液呈强酸性,则可排除OH-的存在;由(2)知道溶液中含有I—,即可排除Ag+、NO3-的存在;(3)不能说明原溶液中有氯离子,因为刚才加入了氯水;(4)加NaOH后产生白色沉淀,可知有Mg2+,同时排除Fe2+;过滤后给滤液加热,有刺激性气味的气体产生,说明为氨气,原溶液中含有NH4+;
(一)NH4+、Mg2+、I-;-
(二)2I-+Cl2=2Cl-+I2 (三)Mg2++2OH-=Mg(OH)2↓
(四)焰色反应(2分),观察是否有黄色火焰。(2分)解析:
(1)用pH试纸检验时,试纸呈深红色,说明溶液呈强酸性,则可排除OH-的存在;由(2)知道溶液中含有I—,即可排除Ag+、NO3-的存在;(3)不能说明原溶液中有氯离子,因为刚才加入了氯水;(4)加NaOH后产生白色沉淀,可知有Mg2+,同时排除Fe2+;过滤后给滤液加热,有刺激性气味的气体产生,说明为氨气,原溶液中含有NH4+;

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
对下列实验过程的评价,正确的是( )
| A.某溶液滴加BaCl2溶液,生成不溶于稀硝酸的白色沉淀,该溶液中不一定含有SO42- |
| B.某无色溶液中滴入酚酞试液变红色,该溶液不一定是碱溶液 |
| C.检验氢气纯度时,将一收集气体的试管移近火焰,没有响声,表明氢气纯净 |
| D.验证烧碱溶液中是否含有Cl-,先加稀盐酸除去OH-,再加AgNO3溶液有白色沉淀出现,证明含Cl- |
(12分)某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的酸度(酸度单位:g/100ml),现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。下表是4种常见指示剂的变色范围:
(1)该实验应选用 作指示剂,向锥形瓶中移取一定体积的白醋所用的仪器是 。
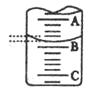
(2)下图表示50ml滴定管中液面的位置,若A与C刻度间相差1ml,A处的刻度为25,滴定管中液面读数为 ml。此时滴定管中液体的体积 。
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为Vml,NaOH标准液浓度为C mol/L,三次实验结果记录如下:
从上表可以看出,第一次实验中记录消耗NaOH溶液体积明显多于后两次,其原因可能
是
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
E.滴定NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出计算该白醋中总酸度的表达式(可以不必化简):
(酸度:每100ml溶液中含有溶质酸的质量,单位:g/100ml)
| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(PH) | 5.0-8.0 | 3.1-4.4 | 4.4-6.2 | 8.2-10.0 |
(2)下图表示50ml滴定管中液面的位置,若A与C刻度间相差1ml,A处的刻度为25,滴定管中液面读数为 ml。此时滴定管中液体的体积 。

(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为Vml,NaOH标准液浓度为C mol/L,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/ml | 26.02 | 25.32 | 25.28 |
是
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
E.滴定NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出计算该白醋中总酸度的表达式(可以不必化简):
(酸度:每100ml溶液中含有溶质酸的质量,单位:g/100ml)
已知某无色透明的溶液中所含的离子仅有Na+、CH3COO-、H+和OH-四种离子,试回答下列问题:
⑴该溶液所含的四种离子的物质的量浓度大小之间的关系是否只有一种可能 (填“是”或“否”),其原因是: 。
⑵某学生将该溶液中的四种离子的物质的量浓度按从大到小的顺序排列了若干种可能,其中合理的是:
⑴该溶液所含的四种离子的物质的量浓度大小之间的关系是否只有一种可能 (填“是”或“否”),其原因是: 。
⑵某学生将该溶液中的四种离子的物质的量浓度按从大到小的顺序排列了若干种可能,其中合理的是:
| A.c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | B.c(CH3COO-)=c(Na+)>c(OH-)=c(H+) |
| C.c(H+)>c(OH-)>c(Na+)>c(CH3COO-) | D.c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
已知某无色透明的溶液中所含的离子仅有Na+、CH3COO-、H+和OH-四种离子,试回答下列问题:
⑴该溶液所含的四种离子的物质的量浓度大小之间的关系是否只有一种可能 (填“是”或“否”),其原因是: 。
⑵某学生将该溶液中的四种离子的物质的量浓度按从大到小的顺序排列了若干种可能,其中合理的是:
⑴该溶液所含的四种离子的物质的量浓度大小之间的关系是否只有一种可能 (填“是”或“否”),其原因是: 。
⑵某学生将该溶液中的四种离子的物质的量浓度按从大到小的顺序排列了若干种可能,其中合理的是:
| A.c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | B.c(CH3COO-)=c(Na+)>c(OH-)=c(H+) |
| C.c(H+)>c(OH-)>c(Na+)>c(CH3COO-) | D.c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |