题目内容
一个化学实验小组人员分别做测量锌跟盐酸反应生成氢气的实验:5人分别称取锌块6.51克,6.52克,6.49克,6.50克,6.48克,生成的氢气用排水法收集,测得分别为:2.25升,2.26升,2.23升,2.24升,2.22升,则由此实验得出的氢气的密度为
- A.8.9×10-5克/厘米3
- B.8.9×10-4克/厘米3
- C.8.9×10-3克/厘米3
- D.8.9×10-2克/厘米3
A
分析:根据密度=质量÷体积,首先根据所给的锌的质量与生成的氢气的关系可得:每0.01克锌生成0.01升的氢气,根据化学反应式可以求出0.01克锌可以生成的氢气的质量,除以体积即可求得密度.
解答:设制得氢气的质量为x克.
Zn+2HCl=ZnCl2+H2↑
65 2
0.01g x
故 =
=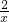
解得:x= g.
g.
 ÷0.01=
÷0.01=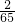 克/升=8.9×10-5克/厘米3
克/升=8.9×10-5克/厘米3
故选A.
点评:本题是一个跨学科问题,利用分式方程解决实际问题,正确理解题目中的关系是解题关键.
分析:根据密度=质量÷体积,首先根据所给的锌的质量与生成的氢气的关系可得:每0.01克锌生成0.01升的氢气,根据化学反应式可以求出0.01克锌可以生成的氢气的质量,除以体积即可求得密度.
解答:设制得氢气的质量为x克.
Zn+2HCl=ZnCl2+H2↑
65 2
0.01g x
故
 =
=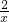
解得:x=
 g.
g. ÷0.01=
÷0.01=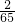 克/升=8.9×10-5克/厘米3
克/升=8.9×10-5克/厘米3故选A.
点评:本题是一个跨学科问题,利用分式方程解决实际问题,正确理解题目中的关系是解题关键.

练习册系列答案
相关题目