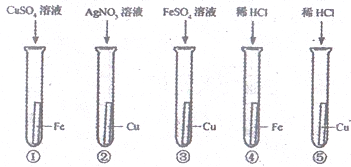
【题目】2020 年 1 月 25 日总建筑面积为 3.39 万平方米的火神山医院正式开工,火神山医院在建造过程中用到了HDPE 膜。老师告诉同学们HDPE 膜具有极好的抗冲击性和防潮性,听完老师的描述后,同学们对HDPE 膜的组成元素产生了浓厚的兴趣,进行了如下探究。
(提出问题)HDPE膜由什么元素组成?
(查阅资料)①HDPE 膜能够燃烧,燃烧可能生成一氧化碳;②碱石灰主要成分是氢氧化钠固体和氧化钙固体。
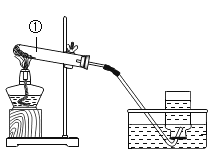
(实验探究)如图所示,先通入干燥氮气,再将 4.2g 的HDPE 膜样品在一定质量的氧气中点燃,并将燃烧产物依次通过装置A、B、C、D(装置中每步反应均进行完全)。
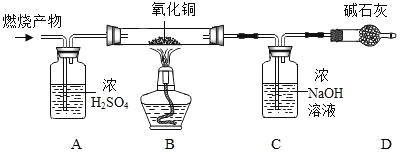
(实验记录)
装置质量 | A 装置总质 量 | C 装置总质 量 |
实验前 | 100.0 g | 100.0 g |
实验后 | 105.4 g | 113.2 g |
(实验分析)
(1)实验前,先通入氮气的目的是___________。
(2)装置A 中浓硫酸的作用是__________。
(3)实验中观察到装置B 中黑色粉末变成红色,证明燃烧产物中有____________。
(4)装置C 中发生的化学反应方程式为__________。
(5)装置D 的作用是______________。
(数据处理)4.2 g 的HDPE 膜样品中含碳元素的质量为______________g,含氢元素的质量为______________g。
(实验结论)HDPE 膜由碳元素、氢元素组成,不含其他元素的理由是___________(用数据分析)。
(反思拓展)实验中的 4.2 g HDPE 膜样品燃烧消耗的氧气质量为m,则m 的取值范围为____________。
【题目】小明同学对蜡烛(主要成分是石蜡)及其燃烧进行了下列探究。
①点燃蜡烛,紧贴烛芯将火柴梗放入火焰中约1 s后取出;
②在火焰上方罩一个冷而干燥的小烧杯;
③用火柴去点白烟;
④切下一块石蜡,放入水中;
⑤熄灭蜡烛;
⑥迅速倒转烧杯,加入澄清石灰水,振荡。
请回答以下问题:
(1)以上操作步骤的正确排序是_____。
(2)按要求填写下列实验现象及其结论。
探究步骤 | 对实验的观察和描述 | 实验结论 |
点燃前 | 石蜡块放入水中观察到的现象:_____ 用指甲在蜡烛表面划过,会_____ | 石蜡的密度比水_____ 石蜡的硬度_____ |
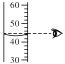
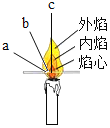
燃着时 | ①点燃蜡烛,把一根火柴梗放在蜡烛的火焰中,如图所示,约1s后取出可以看到火柴梗的_____(选填图中字母)处最先炭化,说明此处温度_____ ②干冷的烧杯内壁出现_____现象,澄清的石灰水_____
| a.蜡烛火焰的_____ 温度最高 b.蜡烛燃烧后的生成物中一定含有_____、_____ |
熄灭后 | 吹灭蜡烛,观察到一缕白烟 | 白烟是_____ |
【题目】实验室中氯酸钾样品含有杂质,为了测定样品中氯酸钾的质量分数,取 10g 该样品与 1g 二氧化锰混合加热 t1 时间后(假设杂质不参加反应),冷却,称量剩余固体质量,重复以上操作,依次称得加热 t2、t3、t4 时间后剩余固体的质量,记录数据如下表:
加热时间 | t1 | t2 | t3 | t4 |
剩余固体质量/g | 10.04 | 9.08 | 8.12 | 8.12 |
(1)请问完全反应后产生氧气的质量为_____g 。
(2)求该样品中氯酸钾的质量分数_____(要求写出计算过程)。反应的化学方程式为:2KClO3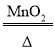 2KCl+ 3O2↑
2KCl+ 3O2↑
【题目】每年的 CES(国际消费类电子产品展览会)都会有一大波“黑科技”产品发布, 而这些产品大多是由金属材料制成,铜是其中重要的金属材料。
I.自然界中的铜主要以化合物形式存在于铜矿石中,从“绿色化学”的理念分析,以下铜矿最适宜炼铜的是_____(填序号)
A 黄铜矿(CuFeS2) B 辉铜矿(Cu2S)
C 蓝铜矿 [Cu(OH)2(CO3)2 ] D 斑铜矿(Cu5FeS4)
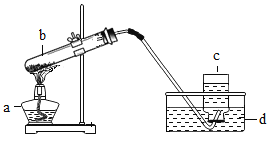
II.某化学兴趣小组用如下实验装置制取一氧化碳,再用一氧化碳还原氧化铜模拟炼铜。
(查阅资料)
(1)实验室常用甲酸(H2CO2)和浓硫酸混合加热制备 CO,同时生成 H2O。
(2)浓硫酸具有吸水性。
(进行实验)小组同学组装好下图装置并检查装置气密性之后开始实验,先让 A 装置反应一会儿,然后熄灭 A 中的酒精灯,再点燃 C 装置中的酒精灯。
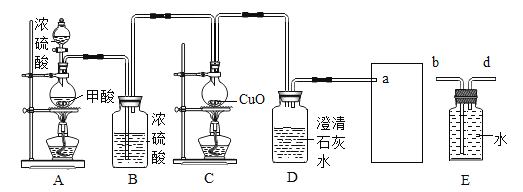
(1)装置 B 的作用是_____;装置 C 中发生反应的化学方程式是_____。
(2)装置 D 的作用是_____;该装置的组装存在的错误是_____; 改正之后,该装置中发生反应的化学方程式是_____。
(3)为避免一氧化碳污染空气,回收利用一氧化碳,方框中应连接装置 E,与 a 导管接口相接的是_____(填“b”或“d”)。
(4)实验结束之后,得到带有金属光泽的砖红色粉末,小组决定对该固体的成分进行探究。
(提出问题)红色的固体是什么?
(查阅资料)氧化亚铜(Cu2O)是红色粉末状固体;
会与稀硫酸反应:Cu2O + H2SO4 == CuSO4 + Cu + H2O。
(提出猜想)猜想一:该固体全部为 Cu;
猜想二:该固体全部为 Cu2O;
猜想三:该固体为 Cu2O 和 Cu 的混合物。
(实验方案)
实验步骤 | 实验现象及实验结论 |
取少量固体粉末于试管中, 加入过量_____溶液。 | 若无明显变化,则猜想一成立; 若溶液变为_____色,则猜想二或猜想三成立。 |
为了进一步确定混合物的组成,另取 m g 固体,重复上述实验,然后将反应后的物质过滤、洗涤、干燥,再次称量得到 n g 固体,若 m 和 n 满足_____的量的关系,则 猜想三成立。
(得出结论)该固体为 Cu2O 和 Cu 的混合物。
(交流讨论)
(1)从实验安全的角度考虑,本实验存在的危险是_____,改进的方法是_____;
(2)从物质的转化程度考虑,小组同学针对如何将氧化铜全部转化为铜单质展开讨论, 查阅了大量资料之后知道,反应条件是影响生成物的重要因素,因此一致认为在下次实验中需要适当加大 CO 的通入量或者_____。