【题目】氧气和氧的化合物在工农业生产、生活中有广泛的应用。
(一)工业制氧气
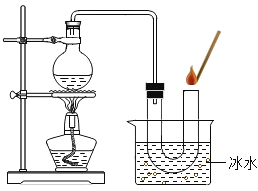
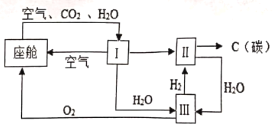
(1)工业上用空气制取氧气。空气中主要组分的沸点如下表:
组分 | 氮气 | 氧气 |
沸点(℃) | -196 | -183 |
根据氧气和氮气的________不同,将液态空气分离得到氧气。
(2)揭开盛有液态空气的保温瓶盖,并将燃着的木条置于瓶口上方,可观察到__________(填字母)。
A 木条熄灭
B 条燃烧更旺
C 木条先熄灭,后燃烧更旺
(二)生活中的氧气
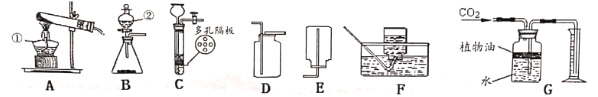
(3)某家庭制氧机上有湿化瓶装置。人吸氧时观察到瓶中有气泡。湿化瓶装置类似于下图。关于该装置,下列说法正确的有____________(填字母)。

A b导管连接制氧机
B b导管连接人吸氧气的塑料管
C 使用该装置可以观测是否有氧气输出
D 使用该装置可以观测氧气输出的速率
(4)下列物质中含有氧分子的有_______(填编号)。
①CO2 ②海水 ③H2O2 ④空气 ⑤液氧 ⑥高锰酸钾
(三)渔业制氧气
(5)运输活鱼时,用过氧化钙(CaO2)可增加水中含氧量。联想到过氧化钙(CaO2)的此作用,小明在实验时,提出下列猜想并用下图装置进行实验:
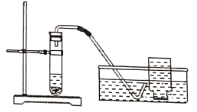
(猜想)CaO2与H2O反应用于实验室制取氧气。
(实验过程)
①____________(填一实验步骤);
②向试管中加入CaO2和H2O后,有极微量细小气泡缓慢放出。将导管伸入集气瓶中,几乎收集不到气体。放置到第二天,集气瓶中只收集到少量气体,震荡试管后仍有极微量细小气泡缓慢放出。
(实验结论)CaO2与H2O反应__________(填“能”或“不能”)用于实验室制取氧气。
(分析与反思)
①结合上述实验,小明认为运输活鱼时用CaO2做增氧剂的优点是_______________。
②小明觉得储存CaO2,注意的问题有______________________。
③同学们对CaO2与H2O反应的生成物猜想如下:Ⅰ.氢氧化钙和氧气 Ⅱ.碳酸钙和氧气
你认为猜想_________(填序号)一定是错误的,理由是_____________________。
按照猜想Ⅰ,写出CaO2与H2O反应的化学表达式_______________________。
(四)CaO2品质的讨论
小明购得用于增氧的CaO2产品一包(杂质不含钙元素),该包标签如图所示。试计算:

(6)CaO2中钙元素与氧元素的质量比为____________。________gCaO2与24.5g KClO3中含氧元素的质量相当。此一包产品至少含CaO2________g。
(7)作为相对原子质量标准的碳原子质量为2.0×1026kg,某种氧原子的相对原子质量为18,则该氧原子质量为___________×1026kg。