【题目】某同学用镁条测定空气中氧气含量,实验完毕,冷却后进入水的体积远大于总容积的1/5,且产生了淡黄色固体。某兴趣小组对此现象作如下探究。
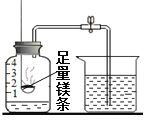
【问题】为什么会生成淡黄色固体?为什么测得氧气的体积分数会明显偏大?
【资料】镁元素化合物的颜色:
物 质 | MgO | MgCl2 | Mg3N2 | Mg(NO3)2 | MgCO3 | Mg(OH)2 |
颜 色 | 白色 | 白色 | 淡黄色 | 白色 | 白色 | 白色 |
【猜想】(1)小组成员一致认为产物中一定不含有氯化镁,理由是__________;
(2)分析资料,小组成员认为淡黄色固体是Mg3N2,是由镁与空气中的______(填化学式)反应生成的,导致进入水的体积远大于总容积的1/5。
【实验】小组成员设计并进行了下列实验。
①组装仪器(如下图,钟罩下端无底)。
②将足量白磷在空气中点燃后,迅速伸入钟罩内,塞紧橡皮塞(图1);
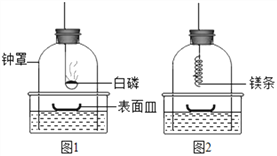
③待钟罩内水面不再变化时,向水槽中加水,使水槽中液面与钟罩内液面相平;
④打开橡皮塞,将燃着的螺旋状镁条迅速伸入钟罩内,塞紧橡皮塞(图2);
⑤待钟罩内水面不再变化时,观察钟罩内壁及表面皿中出现淡黄色固体。
【分析】(3)请将步骤①补充完整____________。
(4)步骤②中将足量白磷在钟罩内燃烧的目的是_________;钟罩内水面的变化情况是___________。
(5)步骤③中加水的目的是为了防止__________。
【结论】小组同学的猜想正确。
【拓展】(6)通过以上探究,你对燃烧有什么新认识?请写一点_____。
