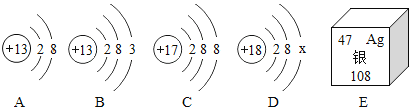
下表为氯化铵和氯化钠在不同温度时的溶解度,回答下列问题:
温度/°C | 0 | 10 | 20 | 30 | 40 | 50 |
NH4Cl溶解度/g | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
NaCl溶解度/g | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
(1)由表中数据可知,溶解度随温度变化较大的物质是____________。
(2)20°C时75g水中最多只能溶解NaCl__________g;氯化钠与氯化铵溶解度相等的温度在_________°C之间。
(3)向烧杯中加入100g水和50. 0g氯化铵配制成50°C的溶液,再冷却到30°C ,烧杯中析出固体的质量为___________g。
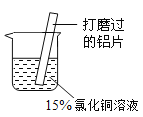
某小组同学在实验室研究铝与氯化铜溶液的反应。
实验操作 | 实验现象 |
| ①红色物质附着于铝片表面 ②铝片表面逸出大量无色气体,放出大量的热 ③烧杯底部出现红色沉淀和白色沉淀 |
(1)打磨铝片的目的是__________________。
(2)现象①和现象③中的红色物质均为Cu,生成该物质的化学方程式为_______________。
(3)经检验,现象②中的无色气体为氢气。小涛猜测可能是氯化铜溶液显酸性.并用pH试纸检验。pH试纸的使用方法是:_______________,把试纸显示的颜色与标准比色卡比较,读出该溶液的pH。测得结果pH______ 7(填“>”、“=”或“ <”),证实了小涛的猜想。
(4)小明通过查阅资料探究白色沉淀的成分,认为可能是氯化亚铜( CuCl)。
[查阅资料]
①CuCl可与浓氨水反应生成无色的Cu(NH3)2+和Cl-。
②Cu( NH3)2+在空气中易被氧化变为蓝色;Cl-可与硝酸银溶液反应,产生白色沉淀。
[进行实验]
①取烧杯底部的白色沉淀,充分洗涤过滤;
③向其中加入浓氨水,沉淀溶解得到无色溶液,并分为两份;
④取其中一份无色溶液
⑤将另一份无色溶液放置于空气中
以上步骤③的实验方案是_____,步骤④的实验现象是____________。
[得出结论]通过实验可以确定,该白色固体是CuCl
[反思与评价]A1和CuCl2溶液反应为什么会出现CuCl呢?
小颖猜测:可能是Cu与CuCl2溶液反应生成了CuCl。
小颖为了验证猜想,取Cu粉与15%CuCl2溶液混合,无白色沉淀产生。
(5)小颖通过分析Al与CuCl2溶液反应的实验现象,改进了实验,从而证明了Cu与CuCl2溶液反应生成了CuCl。改进之处是_________________。