题目内容
【题目】钙是人体必需的元素,它是构成骨骼、牙齿的重要成分。人们可以从牛奶、蔬菜等食物中得到所需的钙元素。如果从食物中摄取的钙元素不足,还可以用葡萄糖酸钙、碳酸钙等的含钙药物来补充,人称“补钙”。
(1)葡萄糖酸钙[化学式是Ca(C6H11O7)2]的相对分子质量是__________________,其中钙、碳、氢、氧四种元素的质量比是___________________。(4分)
(2)某人每天需用含1g碳酸钙[化学式是CaCO3]的药物“补钙”,则他每天补充的钙元素是多少g?(写出计算过程) (3分)(相对原子质量:Ca-40 H-1 O-16 C-12 N-14 Cl-35.5)
(3)_________________克NH4Cl跟80克NH4NO3中的含氮量相等。 (1分)
【答案】(1)430;20:72:11:112(2)0.4克(3)
【解析】
试题分析:相对分子质量=40+12×12+1×22+16×14=430;
钙、碳、氢、氧四种元素的质量之比=40:12×12:1×22:16×14=20:72:11:112
钙元素的质量=![]() X100%=0.4克
X100%=0.4克
设需要X克NH4Cl跟80克NH4NO3中的含氮量相等则:
X×![]() ×100%===80×
×100%===80×![]() ×100% 解的X=107克
×100% 解的X=107克

 阅读快车系列答案
阅读快车系列答案【题目】(8分)做完“铁在氧气里燃烧”实验后,某兴趣小组有一些疑惑不解的问题,于是他们进行了以下探究活动,请你一同参与。
[问题1]细铁丝在氧气中燃烧为什么会“火星四射”?
[查阅资料1]①日常生活中的钢铁制品都含有少量碳杂质。 ②含碳细铁丝燃烧时,其中的炭粒生成的CO2气体在熔融液态物质中形成气泡,熔融液态物质因气泡炸裂引起“火星四射”的现象。
[设计实验]为了探究细铁丝在纯氧中燃烧产生“火星四射”现象的原因,该小组同学设计的实验方案是:取长短粗细相同的含碳细铁丝和不含碳的细铁丝,分别在足量的氧气中燃烧,观察现象。你认为他们的方案 (填“合理”或“不合理”)。
[实验探究1]小明做细铁丝在氧气中的燃烧实验时,他把细铁丝绕成螺旋状,一端系在一根铁丝上,另一端系上一根火柴。点燃火柴后迅速把铁丝连同火柴一起插入集气瓶下部(没有接触到细沙,如图所示),
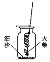
但不见铁丝燃烧,反复实验均未成功。
该同学认为可能导致失败的原因主要有三种:
A.铁丝表面有锈迹,影响了反应的进行;
B.点燃火柴后立即将它伸入瓶内,火柴燃烧消耗了氧气,不利于铁丝的燃烧;
C.火柴燃烧时有大量的热量放出,将铁丝和火柴迅速伸至集气瓶下部,因热胀冷缩之故。瓶内氧气会膨胀逸出,使铁丝无法燃烧。
实验:根据以上假设,他对实验应作的相应改进为:
(1) ; (2) ;(3) 。
[问题2]铁燃烧的产物为什么不是Fe2O3呢?
[查阅资料2]①Fe3O4和Fe2O3的分解温度、铁的熔点见表:②Fe2O3高温时分解成Fe3O4
[理论探讨]根据实验现象,并结合表中数据,可推知铁在氧气里燃烧时产生的高温应在_____之间,在此温度范围内Fe2O3已分解,所以铁在氧气里燃烧的产生是Fe3O4。
Fe3O4 | Fe2O3 | 铁 | |
分解温度/℃ | 1538 | 1400 | — |
熔点/℃ | — | — | 1535 |
[拓展延伸]
小林同学发现“铁丝”在纯净氧气中燃烧起来,观察到火星四射,并有黑色固体生成,请写出该反应的文字表达式 ;
(2)有些超市的食品密封包装盒的透明盖内放有黑色的FeO粉末,若粉末的颜色_____,就说明包装盒破损进气,这样售货员就能及时发现并处理。