题目内容
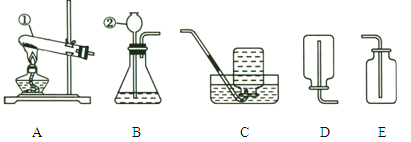
【题目】海水是一种重要的资源,利用海水制取镁等物质。有人设计如图实验流程,下列说法错误的是
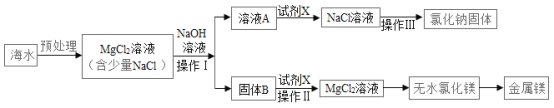
A. 由无水氯化镁制取镁单质,同时还有氯气生成
B. 操作Ⅰ和Ⅲ均用到玻璃棒,且用途相同
C. 加NaOH溶液过量,其目的是使MgCl2完全反应转化为沉淀
D. 处理等量海水,若将NaOH溶液换成石灰乳,能节约成本
【答案】B
【解析】
A、电解氯化镁生成镁和氯气,故A说法正确;
B、过滤可以将不溶性固体从溶液中分离出来,玻璃棒的作用是引流,蒸发可以将溶液中的固体结晶出来,玻璃棒的作用是搅拌,防止局部温度过高造成液滴飞溅,故B说法错误;
C、氢氧化钠和氯化镁反应会生成氢氧化镁沉淀和氯化钠,加入NaOH溶液应过量,其目的是使MgCl2完全反应,故C说法正确;
D、由于氢氧化钙比氢氧化钠的价格便宜,所以将NaOH溶液换成石灰乳,能节约成本,故D说法正确。
故选B。

练习册系列答案
相关题目