题目内容
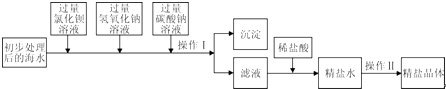
将海水进行处理后获得精盐水.海水中,除氯化钠外,还含有氯化镁、氯化钙、硫酸钠等杂质.其处理的主要流程如下:
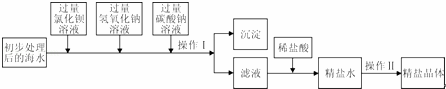
(1)加入过量BaCl2溶液发生反应的化学方程式是 .
(2)加入碳酸钠溶液的目的是 .Na2CO3与BaCl2顺序颠倒则最后所得的精盐水中还含有 .
(3)操作Ⅰ的名称是 .
(4)向滤液中滴加适量稀盐酸的目的是 .
分析:
| (1)氯化钡能和硫酸钠反应生成硫酸钡沉淀和氯化钠,从而除去硫酸钠; (2)碳酸钠能够除去氯化钙和过量的氯化钡,操作不当容易导致最终得到的氯化钠不纯; (3)过滤可以把反应生成的沉淀除去,从而使沉淀和溶液分离; (4)稀盐酸能和氢氧化钠、碳酸钠反应,从而除去滤液中过量的氢氧化钠和碳酸钠. | |
| 解答: | 解:(1)氯化钡和硫酸钠反应的化学方程式为:BaCl2+Na2SO4=BaSO4↓+2NaCl. 故填:BaCl2+Na2SO4=BaSO4↓+2NaCl. (2)加入碳酸钠溶液可以除去氯化钙和过量的氯化钡,碳酸钠和氯化钡顺序颠倒时,过量的氯化钡无法除去,最后所得的精盐水中会含有氯化钡. 故填:除去氯化钙和过量的氯化钡;氯化钡. (3)通过操作Ⅰ可以把产生的沉淀和溶液分离. 故填:过滤. (4)向滤液中滴加适量稀盐酸时,稀盐酸能和过量的氢氧化钠、碳酸钠反应,从而除去氢氧化钠和碳酸钠,得到不含有杂质的氯化钠溶液. 故填:除去滤液中过量的氢氧化钠和碳酸钠. |

练习册系列答案
 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案
相关题目