题目内容
【题目】小芳在实验室用石灰石和稀盐酸制取了二氧化碳,并对实验产生的废液进行溶质成分鉴定:取废液上层清液50克,滴加质量分数为26.5%的碳酸钠溶液,出现气泡,滴加至10克开始出现白色沉淀,继续滴加至沉淀不再产生,过滤,洗涤,干燥,称得沉淀质量为5克,并绘制了图象,如图: 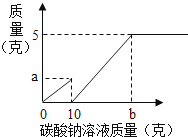
(1)图象中的a点数值
(2)废液中含有的溶质是(写化学式)
(3)通过计算说明,图象横坐标中b点表示的溶液的质量是多少?
【答案】
(1)1.1
(2)HCl、CaCl2
(3)
设与氯化钙反应的碳酸钠溶液中溶质质量为y,
CaCl2+Na2CO3=2NaCl+CaCO3↓
106 100
y 5g
![]() =
=![]() ,y=5.3g;
,y=5.3g;
所需碳酸钠溶液质量是5.3g÷26.5%=20g;
b点表示的溶液的质量为20g+10g=30g.
【解析】(1)图象中的a点数值是二氧化碳的质量,设生成的二氧化碳的质量为x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
10g×26.5% x![]() x=1.1g.
x=1.1g.
(2)取废液上层清液50克,滴加质量分数为26.5%的碳酸钠溶液,出现气泡,说明废液中含有盐酸;滴加至10克开始出现白色沉淀,说明废液中含有氯化钙;故废液是盐酸和氯化钙溶液的混合物,废液中含有的溶质是HCl、CaCl2 .
【考点精析】通过灵活运用根据化学反应方程式的计算,掌握各物质间质量比=系数×相对分子质量之比即可以解答此题.

练习册系列答案
相关题目

