题目内容
(1)小明将氢氧化钠溶液与硝酸钡溶液混合,发现无明显现象.一段时间后,他再次取敞口放置的上述两种溶液进行混合,结果出现了白色沉淀,请解释可能的原因.
(2)金属活动性顺序在运用中给我们三条判断依据,即在金属活动性顺序里:
①金属的位置越靠前它的活动性就越强;
②位于氢前面的金属能置换出盐酸、稀硫酸中的氢;
③位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来.
通过查阅资料我发现金属铝与氧化铜在高温条件下能发生置换反应,其化学方程式为2Al+3CuO
3Cu+Al2O3; 由此我发现了一条新的判断依据
(2)金属活动性顺序在运用中给我们三条判断依据,即在金属活动性顺序里:
①金属的位置越靠前它的活动性就越强;
②位于氢前面的金属能置换出盐酸、稀硫酸中的氢;
③位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来.
通过查阅资料我发现金属铝与氧化铜在高温条件下能发生置换反应,其化学方程式为2Al+3CuO
| ||
在高温条件下,位于前面的金属能把位于后面的金属从它们的氧化物里置换出来
在高温条件下,位于前面的金属能把位于后面的金属从它们的氧化物里置换出来
.分析:(1)氢氧化钠溶液吸收空气中二氧化碳生成碳酸钠,碳酸钠与硝酸钡反应生成碳酸钡沉淀;
(2)金属铝与氧化铜在高温条件下能发生置换反应,生成铜和氧化铝,结合两金属的活动性,推断活动性强的金属与活动性弱的金属的氧化物发生反应的特点.
(2)金属铝与氧化铜在高温条件下能发生置换反应,生成铜和氧化铝,结合两金属的活动性,推断活动性强的金属与活动性弱的金属的氧化物发生反应的特点.
解答:解:(1)敞口放置的氢氧化钠溶液吸收了空气中的二氧化碳而混有碳酸钠,碳酸钠与硝酸钡发生复分解反应生成硝酸钠和碳酸钡沉淀,所以观察到的白色沉淀为碳酸钡;
(2)根据反应的化学方程式2Al+3CuO
3Cu+Al2O3,金属铝与氧化铜在高温条件下能发生置换反应生成铜和氧化铝,结合金属铝的活动性比铜强,可推断得出:在高温条件下,位于前面的金属能把位于后面的金属从它们的氧化物里置换出来.
故答案为:
(1)氢氧化钠溶液吸收空气中的二氧化碳生成了碳酸钠,碳酸钠与硝酸钡溶液反应生成了不溶于水的碳酸钡.
(2)在高温条件下,位于前面的金属能把位于后面的金属从它们的氧化物里置换出来.
(2)根据反应的化学方程式2Al+3CuO
| ||
故答案为:
(1)氢氧化钠溶液吸收空气中的二氧化碳生成了碳酸钠,碳酸钠与硝酸钡溶液反应生成了不溶于水的碳酸钡.
(2)在高温条件下,位于前面的金属能把位于后面的金属从它们的氧化物里置换出来.
点评:本题考查了运用常见物质的性质及变化规律,分析问题、解决问题的能力,体现知识的灵活运用.

练习册系列答案
相关题目
 是,下列说法不正确的是
是,下列说法不正确的是 是,下列说法不正确的是______.
是,下列说法不正确的是______. 3Cu+Al2O3; 由此我发现了一条新的判断依据______.
3Cu+Al2O3; 由此我发现了一条新的判断依据______.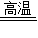 3Cu+Al2O3; 由此我发现了一条新的判断依据______.
3Cu+Al2O3; 由此我发现了一条新的判断依据______.