题目内容
【题目】有一混合气体的成分中可能含有水蒸气、一氧化碳、二氧化碳,某同学设计了如下的实验装置探究混合气体的成分。请根据要求回答下列问题:
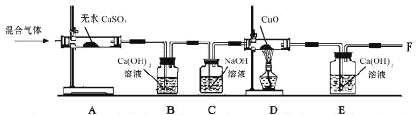
(1)实验中,证明混合气体中有水蒸气的现象是白色固体变为蓝色;若B中澄清石灰水出现 现象,则证明混合气体中有二氧化碳,证明混合气体中有一氧化碳的现象是 或 。
(2)若混合气体中含有CO,在F处尚缺少的实验仪器的名称是 。
(3)如果将上述装置中的A,B交换.则不能检验混合气体中是否含有 。
【答案】(1)浑浊;D中黑色固体变成红色,E中澄清石灰水变浑浊
(2)酒精灯 (3)水蒸气
【解析】本题考查的是实验探究物质的组成成分以及含量,常见气体的检验与除杂方法。
(1)根据无水硫酸铜遇水变蓝和澄清石灰水遇二氧化碳变浑浊,可判断混合气体中有水蒸气和二氧化碳。
如果D中氧化铜变红,说明有一氧化碳气体通过,因为混合气体中只有一氧化碳具有还原性,能还原氧化铜生成铜;或E中澄清石灰水变浑浊,也能说明有一氧化碳气体,因为一氧化碳还原氧化铜可生成二氧化碳,而原混合气体中的二氧化碳已被C氢氧化钠完全反应掉了。
(2)由于CO有毒,故应在F处加一燃着的酒精灯,燃烧掉未反应完的CO。
(3)如果将上述装置中的A,B交换,则无论原混合气体中是否有水蒸气,从B氢氧化钙水溶液中出来的气体中一定带有水蒸气,则不能检验混合气体中是否含有水蒸气。

【题目】溶解是生活中常见的现象,不同物质在水中的溶解能力不同。
(1)下表是KNO3 、NaCl在不同温度下的溶解度:
温度(℃) | 0 | 20 | 30 | 40 | 60 |
KNO3 | 13.3 | 31.6 | 45.8 | 63.9 | 110 |
NaCl | 35. 7 | 36. 0 | 36.3 | 36. 6 | 37.3 |
①20℃时,将40gNaCl放入100g水中,所得溶液的质量是_____________g;
②要除去KNO3中少量的NaCl应用的方法是_______________________;
③硝酸钾和氯化钠在t℃时的溶解度均为W,分析上表可推知,W的数值所在的最小范围是____________________;
(2)用硫酸铜粉末进行如图a、b、c所示的实验,完成下列填空

所得三种溶液中一定属于饱和溶液的是________,溶质的质量分数由大到小的关系是____________。