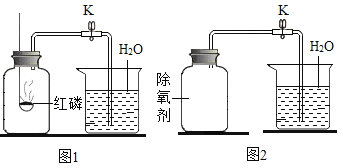
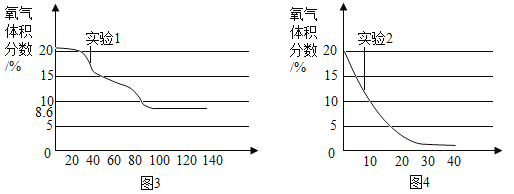
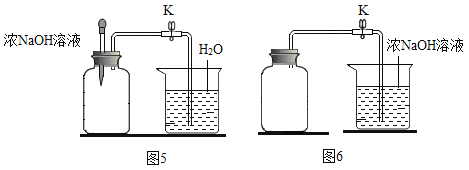
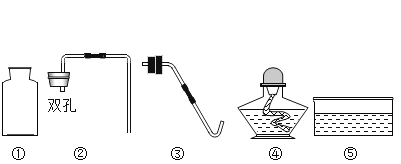
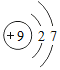题目内容
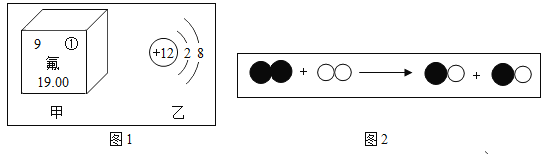
【题目】丙烷(C3H8)是液化石油气的主要成分之一 , 燃烧前后分子种类变化的微观示意图如下。下列说法正确的是(_____)

A在化学变化中,分子可分原子也可分
B乙和丙的元素组成相同
C44g丙烷全燃烧至少需160g 乙
D生成的丙与丁的分子个数比为_____
【答案】C 3:4
【解析】
根据图示可知,甲物质是C3H8,乙物质是O2,二者在点燃的条件下反应,生成丙物质CO2,丁物质H2O。则该反应为: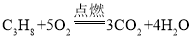 。
。
A、根据化学变化的微观实质可知,化学变化的微观实质是分子的破裂,原子的重新组合,所以在化学变化中,原子不可再分。A错误;
B、通过分析可知,乙物质是氧气,由氧元素组成。丙物质是二氧化碳,由碳、氧两种元素组成。B错误;
C、根据分析可知,每个丙烷分子燃烧至少需要消耗5个氧气分子。丙烷的相对分子质量为44,氧气的相对分子质量为32,则每44g丙烷燃烧,至少需要160g的氧气。C正确;
D、参加化学反应的微粒个数比等于化学计量数之比。则通过分析可知,生成的丙与丁的分子个数比为:3:4。
故选C、3:4。

 名校课堂系列答案
名校课堂系列答案【题目】四氧化三铁可用于医疗器械、电子等工业。某实验兴趣小组从工厂采集废液(含FeSO4和少量ZnSO4、MgSO4),进行四氧化三铁的制备实验。
(阅读资料)
(1)25℃时,氢氧化物沉淀的pH范围如表
Zn(OH)2 | Fe(OH)2 | Mg(OH)2 | |
开始沉淀的pH | 5.7 | 7.6 | 10.4 |
沉淀完全的pH | 8.0 | 9.6 | 12.4 |
(2)25℃时,Zn(OH)2可溶于pH>10.5的碱溶液。
(3)制备Fe3O4的实验流程如下:
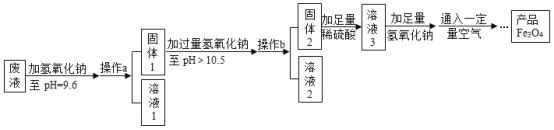
(回答问题)
(1)往废液中加入氢氧化钠溶液生成沉淀的化学方程式为______________(写一个即可)。
(2)操作a的名称为___。该操作需要的玻璃仪器有烧杯、玻璃棒、__________等。玻璃棒在此操作中的主要作用是___。
(3)溶液1所含溶质有_______(至少写两种);溶液3所含溶质的主要成分为___。
【题目】废铁屑主要成分是铁,还有少量铁锈(Fe2O3),硫酸亚铁的生产工艺如图所示。

(1)在反应器中除发生Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,Fe2(SO4)3+Fe═3FeSO4这两个反应外,还会发生另外一个反应,化学方程式为:_____,反应器要加强通风,严禁烟火,其原因是:_____。
(2)将成品在有氧条件下焙烧,可转化为Fe2O3、SO2和SO3.为了提高SO3的产率,某实验小组进行了系列探究,实验数据如下:
编号 | 空气通入量/Ls﹣1 | 温度/℃ | SO2产率% | SO3产率/% |
a | 0.02 | 850 | 45.4 | 54.6 |
b | 0.06 | 850 | 30.5 | 69.5 |
c | 0.10 | 810 | 11.1 | 88.9 |
d | 0.10 | 850 | 11.1 | 88.9 |
e | 0.10 | 890 | 11.2 | 88.8 |
①本实验主要研究了哪些因素对SO3产率的影响_____。
②根据上表数据,生产过程中采用实验_____(填编号)的提取条件最合理。