题目内容
通过一年的化学学习,我们知道了常见气体的实验室制取方法和相关性质,我能根据所学知识回答下列问题:
(1)图1是实验室常用的制取气体的装置:
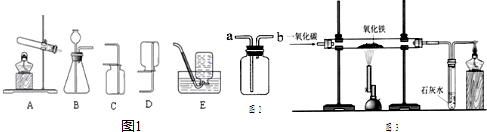
实验室用氯酸钾制取氧气的化学方程式是________,所选用的发生装置是________(填序号,下同),选择E装置收集氧气判断已经集满氧气的现象是________.
(2)小丽欲使用图2装置收集较纯净的氢气,具体的操作________.
(3)小丽收集一瓶氧气,然后将燃着的硫放入该集气瓶中继续做气体性质实验,硫在氧气中燃烧的现象是________.实验结束,为了防止生成的气体污染空气,小丽向集气瓶中加入澄清石灰水,有关反应的化学方程式为________.
(4)炼铁的原理是利用一氧化碳与氧化铁反应,在实验室里,可用图3所示装置进行实验:
实验中玻璃管内的现象________,该反应的化学方程式为________酒精灯的作用是________.
解:(1)如果用高锰酸钾或氯酸钾制氧气就需要加热;氯酸钾在二氧化锰做催化剂和加热的条件下生成氯化钾和氧气,配平即可;排水法验满的方法是:当气泡从集气瓶口向外冒出时,证明已满.故答案为:2KClO3 2KCl+3O2↑;A;当气泡从集气瓶口向外冒出时,证明已满
2KCl+3O2↑;A;当气泡从集气瓶口向外冒出时,证明已满
(2)因为氢气难溶于水,用排水法收集的比较纯净,用图2装置收集较纯净的氢气,具体的操作是:在集气瓶中装满水,氢气从b端进入;故答案为:在集气瓶中装满水,氢气从b端进入;
(3)硫在纯氧中的现象是:明亮的蓝紫色火焰、放出热量、生成有刺激性气味的气体;二氧化硫和石灰水反应生成亚硫酸钙白色沉淀和水,故答案为:明亮的蓝紫色火焰、放出热量、生成有刺激性气味的气体;Ca(OH)2+SO2=CaSO3↓+H2O
(4)实验中玻璃管内的现象是:红色变黑色;一氧化碳做还原剂要注意尾气处理;一氧化碳和氧化铁在高温下反应生成铁和二氧化碳,配平即可.故答案为:红色变黑色;3CO+Fe2O3 2Fe+3CO2;处理尾气
2Fe+3CO2;处理尾气
分析:制取装置包括加热和不需加热两种,如果用双氧水制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集;排水法验满的方法是:当气泡从集气瓶口向外冒出时,证明已满.实验室是用锌粒和稀硫酸在常温下反应制氢气的,氢气难溶于水,密度比空气的密度小,因此可以用排水法和向下排空气法收集,排水法收集的比较纯净.硫在纯氧中的现象是:明亮的蓝紫色火焰、放出热量、生成有刺激性气味的气体.利用一氧化碳的还原性来达到炼铁的目的,一氧化碳做还原剂配平时,可以利用最小公倍数法,也可以从得氧和失氧的角度分析;一氧化碳做还原剂要注意尾气处理.
点评:本题考查的是气体的制取装置和收集装置的选择、验满的方法、氧气和一氧化碳的性质等,气体的制取装置的选择与反应物的状态和反应的条件有关;收集装置的选择与气体的密度和溶解性有关.要记住硫 氧气中燃烧的现象,一氧化碳的可燃性和还原性等知识点;本考点综合性比较强,是中考的重要考点之一,主要出现在实验题中.
 2KCl+3O2↑;A;当气泡从集气瓶口向外冒出时,证明已满
2KCl+3O2↑;A;当气泡从集气瓶口向外冒出时,证明已满(2)因为氢气难溶于水,用排水法收集的比较纯净,用图2装置收集较纯净的氢气,具体的操作是:在集气瓶中装满水,氢气从b端进入;故答案为:在集气瓶中装满水,氢气从b端进入;
(3)硫在纯氧中的现象是:明亮的蓝紫色火焰、放出热量、生成有刺激性气味的气体;二氧化硫和石灰水反应生成亚硫酸钙白色沉淀和水,故答案为:明亮的蓝紫色火焰、放出热量、生成有刺激性气味的气体;Ca(OH)2+SO2=CaSO3↓+H2O
(4)实验中玻璃管内的现象是:红色变黑色;一氧化碳做还原剂要注意尾气处理;一氧化碳和氧化铁在高温下反应生成铁和二氧化碳,配平即可.故答案为:红色变黑色;3CO+Fe2O3
 2Fe+3CO2;处理尾气
2Fe+3CO2;处理尾气分析:制取装置包括加热和不需加热两种,如果用双氧水制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集;排水法验满的方法是:当气泡从集气瓶口向外冒出时,证明已满.实验室是用锌粒和稀硫酸在常温下反应制氢气的,氢气难溶于水,密度比空气的密度小,因此可以用排水法和向下排空气法收集,排水法收集的比较纯净.硫在纯氧中的现象是:明亮的蓝紫色火焰、放出热量、生成有刺激性气味的气体.利用一氧化碳的还原性来达到炼铁的目的,一氧化碳做还原剂配平时,可以利用最小公倍数法,也可以从得氧和失氧的角度分析;一氧化碳做还原剂要注意尾气处理.
点评:本题考查的是气体的制取装置和收集装置的选择、验满的方法、氧气和一氧化碳的性质等,气体的制取装置的选择与反应物的状态和反应的条件有关;收集装置的选择与气体的密度和溶解性有关.要记住硫 氧气中燃烧的现象,一氧化碳的可燃性和还原性等知识点;本考点综合性比较强,是中考的重要考点之一,主要出现在实验题中.

练习册系列答案
相关题目


