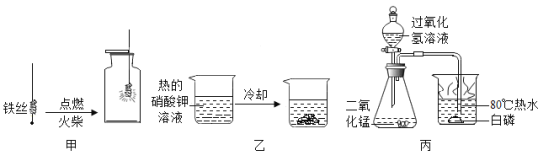
题目内容
【题目】生活中处处有化学,化学与生活密切相关。
(1)某饼干包装袋中用作干燥剂的是生石灰(CaO),这是利用了生石灰能与水反应的性质,请写出该反应的化学方程式:_____。
(2)CO2常用于灭火,但镁着火不能用CO2灭火,原因是镁能在CO2中燃烧生成一种黑色固体,请写出该置换反应的化学方程式:____
【答案】CaO+H2O=Ca(OH)2 2Mg+CO2![]() C+2MgO
C+2MgO
【解析】
(1) 生石灰与水反应生成氢氧化钙,反应的化学方程式为:CaO+H2O═Ca(OH)2;
(2) 镁着火不能用CO2灭火,原因是它们能发生反应生成另一种氧化物和单质,由质量守恒定律,该氧化物是氧化镁,单质是碳,反应的化学方程式为:2Mg+CO2![]() C+2MgO。
C+2MgO。

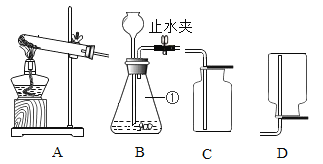
【题目】在学习“燃烧与灭火”的课堂上,老师做了一个有趣的实验:将一 根铜丝绕成线圈,罩在蜡烛火焰上(如图所示),观察到火焰立即熄灭。
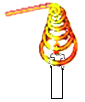
(1)探究一:蜡烛熄灭的原因。
猜想与假设:a铜线圈隔离了可燃物;
b铜线圈隔绝了空气;
c铜线圈吸热,降温至蜡烛着火点以下。
讨论与交流:经观察分析同学们否定了猜想a和b,理由是___________________。
设计并进行如下实验:
实验操作 | 实验现象 | 结论 |
将铜圈加热后____________, | 蜡烛正常燃烧 | 猜想c正确 |
(2)探究二:经过多次上述实验大家发现铜丝表面变黑,黑色物质是什么呢?
猜想与假设:①炭黑;②氧化铜;③炭黑和氧化铜。
[查阅资料] :氧化铜可与稀硫酸反应生成硫酸铜(溶液显蓝色)和水,炭黑不与稀硫酸反应。
讨论交流:铜丝表面产生发炭黑或氧化铜的原因是_________________(写一条即可)。
实验操作 | 实验现象 | 结论 |
取少许黑色固体至试管中________________, | 固体部分溶解溶液变蓝色 | 猜想③正确 |
【题目】某同学为了测定铜镁混合物中铜的质量分数,将100g稀盐酸分2次加入到盛有5g该固体混合物的烧杯中,所得数据如下表。(提示:铜镁混合物中的镁能和稀盐酸反应生成氯化镁和氢气,而铜不与稀盐酸反应、也不溶于水)则下列说法中错误的是( )
次数 | 实验前 | 第1次 | 第2次 |
加入稀盐酸的质量/g | 0 | 50 | 50 |
剩余固体的质量/g | 5 | 3 | 2 |
A.第1次加入稀盐酸后剩余固体中还有镁
B.第2次所加入的稀盐酸未反应完
C.每50g稀盐酸和1g镁恰好能完全反应
D.原混合物中铜的质量分数为40%