题目内容
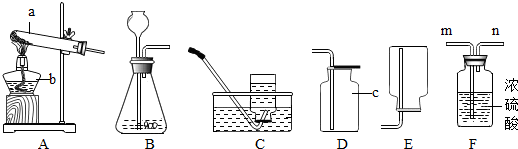
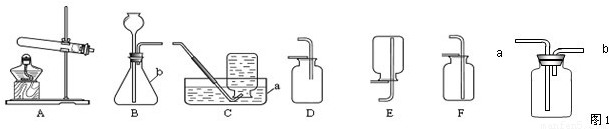
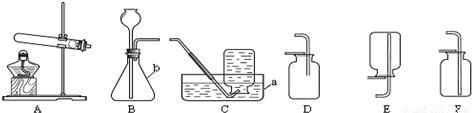
实验室制取气体所需装置如图所示,请回答以下问题:
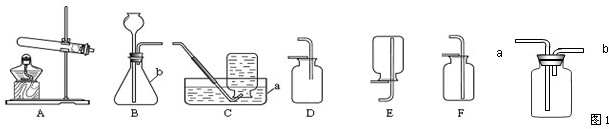
(1)仪器a的名称是
(2)用高锰酸钾制取氧气时,所选用的发生装置是
(3)硫化氢(H2S)是一种有毒气体,其密度比空气密度大,且能溶于水形成氢硫酸.实验室通常用块状固体硫化亚铁(FeS)和稀硫酸混合,在常温下通过复分解反应制取硫化氢气体.试回答:
①实验室制取硫化氢气体的化学方程式
制取硫化氢气体的发生装置可选择
②为了验证氢硫酸水溶液呈酸性,图1装置中应装的试剂是
③为了防止多余硫化氢逸出污染空气,可用

(1)仪器a的名称是
水槽
水槽
.(2)用高锰酸钾制取氧气时,所选用的发生装置是
A
A
(填字母序号,下同),其化学反应方程式为2KMnO4
K2MnO4+MnO2+O2↑
| ||
2KMnO4
K2MnO4+MnO2+O2↑
.如果要制得较纯净的氧气应该选择装置
| ||
C
C
收集.(3)硫化氢(H2S)是一种有毒气体,其密度比空气密度大,且能溶于水形成氢硫酸.实验室通常用块状固体硫化亚铁(FeS)和稀硫酸混合,在常温下通过复分解反应制取硫化氢气体.试回答:
①实验室制取硫化氢气体的化学方程式
H2SO4+FeS═H2S↑+FeSO4
H2SO4+FeS═H2S↑+FeSO4
制取硫化氢气体的发生装置可选择
B
B
若用图1装置来收集硫化氢气体,进气口应为a
a
,原因是H2S的密度比空气大
H2S的密度比空气大
.②为了验证氢硫酸水溶液呈酸性,图1装置中应装的试剂是
紫色石蕊试液
紫色石蕊试液
现象是紫色石蕊试液变红
紫色石蕊试液变红
.③为了防止多余硫化氢逸出污染空气,可用
氢氧化钠溶液
氢氧化钠溶液
来吸收.反应的化学方程式为2NaOH+H2S═Na2S+2H2O
2NaOH+H2S═Na2S+2H2O
.分析:(1)依据常用仪器回答;
(2)依据高锰酸钾制取氧气反应物的状态和反应条件选择发生装置,并据反应原理书写方程式;
(3)①依据题意:硫化亚铁和稀硫酸常温反应,反应类型是复分解反应.可写出方程式;根据反应状态,反应条件选择发生装置,并据气体的密度选择收集装置;
②根据硫化氢气体的溶于水的性质作判断.能溶于水形成氢硫酸,因此它的酸性可以用石蕊试液验证;
③依据硫化氢气体的性质,可以用碱液吸收.
(2)依据高锰酸钾制取氧气反应物的状态和反应条件选择发生装置,并据反应原理书写方程式;
(3)①依据题意:硫化亚铁和稀硫酸常温反应,反应类型是复分解反应.可写出方程式;根据反应状态,反应条件选择发生装置,并据气体的密度选择收集装置;
②根据硫化氢气体的溶于水的性质作判断.能溶于水形成氢硫酸,因此它的酸性可以用石蕊试液验证;
③依据硫化氢气体的性质,可以用碱液吸收.
解答:解:(1)仪器a是水槽;
(2)用高锰酸钾制取氧气时需要加热,故选发生装置A;加热高锰酸钾生成锰酸钾、二氧化锰和氧气,方程式是2KMnO4
2MnO4+MnO2+O2↑;
(1)硫化亚铁和硫酸反应生成硫酸亚铁和水,方程式是FeS+H2SO4=FeSO4+H2S↑;根据题目信息,该反应是固体和液体在常温下发生复分解反应制得硫化氢气体,因此发生装置选用B;其密度大于空气,因此可用图示装置来收集;
②硫化氢气体能溶于水形成氢硫酸,酸性溶液可使石蕊变红,因此要检验它的酸性可以用石蕊试液验证;
③酸和碱可发生反应,所以多余的硫化氢气体可用氢氧化钠溶液等碱液吸收;
故答案为:(1)水槽;
(2)A;2KMnO4
K2MnO4+MnO2+O2↑;
(3)①FeS+H2SO4=FeSO4+H2S↑;B;硫化氢气体密度大于空气密度;
②紫色石蕊试液;紫色石蕊试液变红;
③氢氧化钠溶液;2NaOH+H2S═Na2S+2H2O.
(2)用高锰酸钾制取氧气时需要加热,故选发生装置A;加热高锰酸钾生成锰酸钾、二氧化锰和氧气,方程式是2KMnO4
| ||
(1)硫化亚铁和硫酸反应生成硫酸亚铁和水,方程式是FeS+H2SO4=FeSO4+H2S↑;根据题目信息,该反应是固体和液体在常温下发生复分解反应制得硫化氢气体,因此发生装置选用B;其密度大于空气,因此可用图示装置来收集;
②硫化氢气体能溶于水形成氢硫酸,酸性溶液可使石蕊变红,因此要检验它的酸性可以用石蕊试液验证;
③酸和碱可发生反应,所以多余的硫化氢气体可用氢氧化钠溶液等碱液吸收;
故答案为:(1)水槽;
(2)A;2KMnO4
| ||
(3)①FeS+H2SO4=FeSO4+H2S↑;B;硫化氢气体密度大于空气密度;
②紫色石蕊试液;紫色石蕊试液变红;
③氢氧化钠溶液;2NaOH+H2S═Na2S+2H2O.
点评:本题考查发生和收集装置的选取,以及硫化氢气体的制取、性质等知识,能很好培养学生根据所学知识处理新问题的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目