题目内容
称取铜、锌混合物粉末10.0g置于烧杯中,慢慢加入稀硫酸使其充分反应,直至固体质量不再减少为止,此时用去49.0g稀硫酸.剩余固体3.5g.(1)该混合物粉末中铜的质量分数为多少?
(2)所用的稀硫酸溶质的质量分数是多少?
【答案】分析:(1)剩余固体是铜,由铜和混合物的质量可以计算出混合物中铜的质量分数和锌的质量.
(2)由锌和稀硫酸的质量根据锌和硫酸反应的化学方程式可以计算出稀硫酸的溶质质量分数.
解答:解:(1)混合物中铜的质量分数为
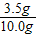 ×100%=35%
×100%=35%
(2)设稀硫酸中溶质的质量分数为x.
Zn+H2SO4=ZnSO4+H2↑
65 98
10.0g-3.5g 49.0g?x
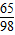 =
= ,x=20%
,x=20%
答:(1)混合物中铜的质量分数为35%.
(2)稀硫酸中溶质的质量分数为20%.
点评:本题主要考查含杂质物质的化学方程式计算和溶质质量分数的计算,难度较大.
(2)由锌和稀硫酸的质量根据锌和硫酸反应的化学方程式可以计算出稀硫酸的溶质质量分数.
解答:解:(1)混合物中铜的质量分数为
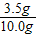 ×100%=35%
×100%=35%(2)设稀硫酸中溶质的质量分数为x.
Zn+H2SO4=ZnSO4+H2↑
65 98
10.0g-3.5g 49.0g?x
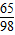 =
= ,x=20%
,x=20%答:(1)混合物中铜的质量分数为35%.
(2)稀硫酸中溶质的质量分数为20%.
点评:本题主要考查含杂质物质的化学方程式计算和溶质质量分数的计算,难度较大.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目