��Ŀ����
����Ŀ��Ϊ�Ƚ���ͬŨ�ȵ�FeCl3��Һ��CuSO4��Һ��H2O2�ֽ�Ĵ�Ч����ij�о�С�����������̽���� 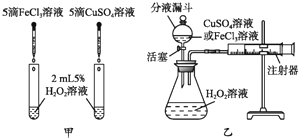
��1����д��H2O2�ֽ�Ļ�ѧ����ʽ�� ��
��2��������̽����
��ͼ�ף���ͨ���۲������ԱȽ����ߵĴ�Ч����
��3��������̽����
��ͼ�ң�ʵ��ǰ����װ�õ������Եķ����ǽ�ע���������������� �� ��װ�����������ã�Ҫ�����Ƚ����ߵĴ�Ч�����ɲ������ɵ������������� ��
��4��������̽����
��FeCl3��Һ�У�����������������������أ�
����1�������ӣ�Fe3+��������ã�
����2��������ã�
��
�����ʵ�飬��֤����1
ʵ����� | ʵ������ | ʵ������ |
����1���� |
���𰸡�
��1��2H2O2![]() 2H2O+O2��
2H2O+O2��
��2���������ݵ�����
��3�����ɿ��ֻ����ֻص�ԭ����λ�ã�ʱ��
��4�������ӣ�Cl�������ֱ�ȡij�����ͬ��H2O2��Һ��2֧�Թ��У��ٷֱ�����������FeCl3��NaCl������FeCl3���Թ��в���������죬����NaCl���Թ��в�����������
����������1�����������ڴ����������·ֽ�Ϊ������ˮ�����2H2O2![]() 2H2O+O2������2���Ƚ��������ʶԹ�������ֽ����ʵ�Ӱ�죬���Թ۲���߲������ݵ����ʣ�����������ݵ����ʣ���3������װ�õ������ԣ����Ƚ���Һ©���Ļ����رգ�Ȼ����˫�ֽ�����ƿ����ڣ�Ȼ��۲�ע�����Ļ����Ƿ������ƶ������ɿ��ֻ����ֻص�ԭ����λ�ã�˵����װ�õ������������õģ������Ĵ�Ч��Խ�ã���Ӧ�������������Խ�죬��ͨ�������������������������Ҫ��ʱ��������������ʱ��Խ�̣���Ч��Խ�ã�������ɿ��ֻ����ֻص�ԭ����λ�ã�ʱ�䣻��4����FeCl3��Һ����Ҫ�������ӣ�Fe3+���������ӣ�Cl���������Բ���2�������ӣ�Cl�����������ӣ�Fe3+���������ӣ�Cl��������֤����1�������ӣ�Fe3+��������ã���Ҫ���һ���Ա�ʵ�飬��ȡ�ĵ������ͬ�ֹ���������Һ�����Ӧ��ͬ������������к��������ӣ������������ӣ����Ȼ��ƣ����ݷ�Ӧ�ٶȵĿ���֤��������õ��������ӣ�Fe3+������������ӣ�Cl������
2H2O+O2������2���Ƚ��������ʶԹ�������ֽ����ʵ�Ӱ�죬���Թ۲���߲������ݵ����ʣ�����������ݵ����ʣ���3������װ�õ������ԣ����Ƚ���Һ©���Ļ����رգ�Ȼ����˫�ֽ�����ƿ����ڣ�Ȼ��۲�ע�����Ļ����Ƿ������ƶ������ɿ��ֻ����ֻص�ԭ����λ�ã�˵����װ�õ������������õģ������Ĵ�Ч��Խ�ã���Ӧ�������������Խ�죬��ͨ�������������������������Ҫ��ʱ��������������ʱ��Խ�̣���Ч��Խ�ã�������ɿ��ֻ����ֻص�ԭ����λ�ã�ʱ�䣻��4����FeCl3��Һ����Ҫ�������ӣ�Fe3+���������ӣ�Cl���������Բ���2�������ӣ�Cl�����������ӣ�Fe3+���������ӣ�Cl��������֤����1�������ӣ�Fe3+��������ã���Ҫ���һ���Ա�ʵ�飬��ȡ�ĵ������ͬ�ֹ���������Һ�����Ӧ��ͬ������������к��������ӣ������������ӣ����Ȼ��ƣ����ݷ�Ӧ�ٶȵĿ���֤��������õ��������ӣ�Fe3+������������ӣ�Cl������
ʵ����� | ʵ������ |
�ֱ�ȡij�����ͬ��H2O2��Һ��2֧�Թ��У��ٷֱ�����������FeCl3��NaCl | ����FeCl3���Թ��в���������죬����NaCl���Թ��в����������� |
�����㾫����������Ŀ����֪���������ô������ص�������ú���д��ѧ����ʽ�����ֱ���ʽ�����뷽��ʽ�����֪ʶ���Եõ�����Ĵ𰸣���Ҫ���մ�������ý�����ڻ�ѧ��Ӧ���ܸı��������ʵĻ�ѧ��Ӧ���ʣ��������������ͻ�ѧ�����ڷ�Ӧǰ��û�з����仯�����ʣ���һ�������䣩�����ڻ�ѧ��Ӧ����������ýд����ã�ע�⣺a����ƽ b������ c�����ţ�

 ��Ȥ������ҵ���ϿƼ�������ϵ�д�
��Ȥ������ҵ���ϿƼ�������ϵ�д�