题目内容
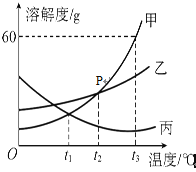
【题目】NaCl、KNO3物质的溶解度曲线如图

① a点表示的意义是20℃时,在_______中最多溶解硝酸钾31.6克。
② 60℃时,50克水中加入_______克硝酸钾恰好形成饱和溶液,再往该溶液中加入115克水后,硝酸钾溶液的溶质质量分数是________。
③ 提纯混合溶液中的硝酸钾,进行如下实验。

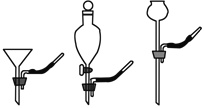
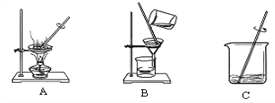
操作III为下图中的_______(填序号),溶液M中所含溶质为______________。
④ 20℃时,将等质量的NaCl、KNO3固体分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1,加热到60℃时现象如图2(不考虑水分蒸发)。根据NaCl、KNO3物质的溶解度曲线回答:

甲烧杯中的加入固体是________(填“KNO3”或“NaCl”)。
对乙烧杯中溶液的分析,正确的是_________(选填编号)
Ⅰ.从20℃升温到60℃过程中,溶质质量没有改变
Ⅱ.20℃时,其中溶质与溶剂的质量比为31.6:100
Ⅲ.将溶液从20℃降温,一定会析出晶体
Ⅳ.60℃时,乙烧杯中溶液一定是不饱和溶液
【答案】100克水5525%(或0.25或1/4)BKNO3、NaClKNO3Ⅰ、Ⅳ (答对一个得一分)
【解析】①溶解度为一定温度下,100g溶剂最多溶解的溶质的量,因此为100g水;②60℃时,硝酸钾的溶解度为110g,那么50g水溶解110g÷2=55g溶质恰好饱和;质量分数=溶质质量/溶液质量×100%=55g/(55g+50g+115g) ×100%=25%;③为分离固体和液体,应为过滤;氯化钠未析出,硝酸钾析出大部分,因此都还含有;④由图1可得20℃时,甲的溶解度小于乙,那么甲为硝酸钾;乙为氯化钠溶液,氯化钠溶解度随温度升高而增大,Ⅰ、未由溶质析出,也未添加溶质,因此溶质不变,正确,Ⅱ、溶质的量未确定,因此无法确定,错误,Ⅲ、未确定其是否饱和,若饱和则肯定有析出,若不饱和则不确定,错误,Ⅳ、升温溶解度增大,那么升温还可以继续溶解,一定为不饱和,正确,综上,为Ⅰ、Ⅳ。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
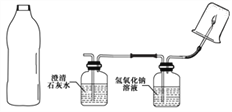
鸿图图书寒假作业假期作业吉林大学出版社系列答案【题目】化学实验小组用排水法收集了一大瓶沼气池中气体(图1中的A),为检测它的成分,进行下列探究实验活动。(资料:氢氧化钠溶液能与二氧化碳发生反应)
【猜想与假设】①是CH4; ②是CH4和CO2的混合气体
③是CO和CO2的混合气体。
【实验和推断】将A中的气体依次通入B、C中,在D处点燃。
A B C D |
② ③ |
图1 | 图2 |
(1)要将A中的气体通入后面的装置中,应选图2中的_____ (填序号)“注水装置”。
(2)B中石灰水变浑浊,则说明A中的气体中含有_____气体。
(3)装置C作用是______。
(4)当D处倒扣的是涂有澄清石灰水的烧杯,出现浑浊;当D处倒扣的是干冷的大烧杯,杯壁有水雾出现。
实验结论是____,其理由是____。我对此实验的改进建议是____。