题目内容
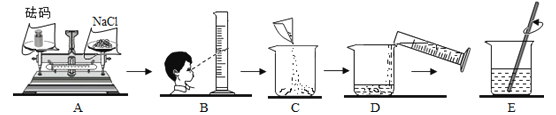
【题目】粗盐中除NaCl外还含有MgSO4以及泥沙等杂质。初步提纯粗盐的实验流程如下:

(1)“滤渣”是粗盐中含有的。
(2)实验过程中四次用到玻璃棒,分别是:
第一次:溶解时搅拌;
第二次:;
第三次:;
第四次:将精盐从蒸发皿转移出来。
(3)本实验从滤液得到精盐,采用的是蒸发溶剂的方法而不用降低溶液温度的方法,参考溶解度曲线图分析的原因: ;

(4)看图可知,200C时NaCl的溶解度为 g,本实验溶解3.6g的粗盐,蒸馏水的最佳使用量约为 ml.增加蒸馏水的用量虽然能加快粗盐的溶解,但会引起的不良后果是 。
【答案】(1)泥沙
(2)过滤时引流 蒸发时搅拌
(3)氯化钠的溶解度受温度影响变化不大
(4)36 10 不利于后续蒸发溶剂,蒸发溶剂时间会大大延长,消耗燃料。
【解析】(1)滤渣是指粗盐中含有的泥沙等不溶性杂质;
(2)第二次的操作是过滤,过滤中玻璃棒的作用是引流;第三次的操作时蒸发结晶,蒸发中玻璃棒的作用是搅拌防止局部温度过高,造成液滴飞溅;
(3)氯化钠的溶解度受温度影响变化不明显,降低温度只能析出很少量的晶体,故采用蒸发结晶的方法得到精盐;
(4)看图可知,200C时NaCl的溶解度为36g,即100g水中最多溶解36g氯化钠,则溶解3.6g食盐至少需要水的质量为10g,合10ml。若加入的水量过多,要得到氯化钠晶体则会增加蒸发溶剂的时间,浪费能源。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目