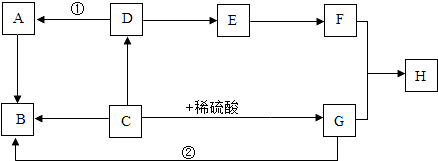
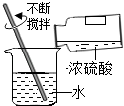
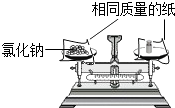
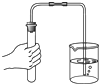
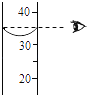��Ŀ����
����Ŀ��С��ͬѧ��ʵ���ҷ���һƿ���ڷ��õĹ���������Һ����ΪҪ���²ⶨŨ�Ȳ������Լ�ƿ�ı�ǩ������������ʵ�飺��ȡ����Һ34.0g�����ձ��У�Ȼ�����ձ�����1.0g�������̣��ò���������ֱ�����ٷų����壬�ٳ����ձ��л���������Ϊ34.6g���������ɵ�����ȫ���ݳ�������
��1����������������Ϊg��
��2������ʽ������ƿ����������Һ�����ʵ����������������ȷ��0.1%����
���𰸡�
��1��0.4
��2���⣺�����0.4g������Ҫ�������������Ϊx
2H2O2 | O2�� |
68 | 32 |
X | 0.4g |
![]()
x=0.85g
�˹���������Һ�����ʵ���������Ϊ ![]() ��100%=2.5%
��100%=2.5%
���������⣺��1���������̵�������0.5g�������ɵ����������Ϊ��34.0g+1.0g��34.6g=0.4g���𰸣���1��0.4��2����ƿ����������Һ�����ʵ���������2.5%
�����㾫����������Ҫ�����˸��ݻ�ѧ��Ӧ����ʽ�ļ�������֪ʶ�㣬��Ҫ���ո����ʼ�������=ϵ������Է�������֮�Ȳ�����ȷ�����⣮

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ������ʱʵ������һƿ��ǩ��ȱ���Լ�����ͼ�������Լ���NaHCO3��NaCl��NaOH�е�һ�֣�ijѧϰС���������ɷֽ���̽���� 
�����Ŀ�֪�����������ʵ��ܽ�ȣ�����ʱ�����£�
���� | NaHCO3 | NaCl | NaOH |
�ܽ��/g | 9.6 | 36.0 | 109.0 |
��1��ѧϰС����ݱ�ǩ�����жϣ���ƿ�Լ�����������Һ������ţ���
A.��
B.��
C.��
��2��ѧϰС���ָ��ݱ�ǩ���ϱ��е������жϣ���ƿ�Լ�����������Һ��
��3��ѧϰС��ȡ��������Һ�����뼸����ɫʯ����Һ����Һ����ɫ���ɴ��ж���ƿ�Լ�Ӧ������Һ��