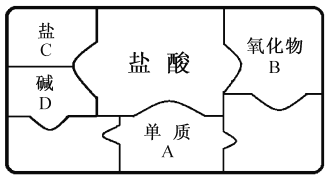
题目内容
【题目】将一定质量的金属锌投入到63.7 g稀硫酸中,恰好完全反应,放出气体的质量与反应时间的关系如图所示。试求:(计算结果精确到0.1%)

(1)完全反应后生成氢气的质量为________g。
(2)所用硫酸溶液中溶质的质量分数。
(3)反应结束后所得溶液的质量。
【答案】(1)0.2;(2)15.4%;(3)70 g
【解析】试题分析:(1)由放出气体的质量与反应时间的关系图可知,生成氢气的质量为0.2g;
(2)设参加反应锌、硫酸溶液中溶质的质量分别为x、y
Zn+H2SO4=ZnSO4+H2↑
65982
xy0.2g
![]()
解得:x=6.5gy=9.8g
所用硫酸溶液中溶质的质量分数为:![]() ×100%=15.4%
×100%=15.4%
(3)由质量守恒定律可知,反应结束后所得溶液的质量为:63.7g+6.5g﹣0.2g=70g.

【题目】在研究酸和碱的化学性质时,某小组想证明稀硫酸与氢氧化钠溶液混合后,虽然无明显现象,但确实发生了化学反应,试与他们一起完成实验方案的设计、实施和评价,并得出有关结论。
(1)探究稀硫酸与氢氧化钠溶液的反应:

当滴入几滴酚酞试液后,溶液由无色变为___________色,根据上述实验中颜色变化,可确定稀硫酸与氢氧化钠溶液发生了化学变化,反应的化学方程式为:_______________。
(2)探究上述稀硫酸与氢氧化钠溶液反应后烧杯中的硫酸是否过量:
根据上述反应过程中溶液变成无色,不能确定稀硫酸是否过量,同学们又分别选取氯化钡溶液、紫色石蕊试液设计实验方案,请你判断并分析:
实验方案 | 实验步骤 | 实验现象 | 实验结论 |
方案一 | 取样,滴入适量的氯化钡溶液 | 出现白色沉淀 | 稀硫酸过量 |
方案二 | 取样,滴入几滴紫色石蕊试液 | 溶液变红 | 稀硫酸过量 |
上述设计的实验方案中,正确的是_______________(填“方案一”或“方案二”)
另外一个实验方案错误的原因是__________________________________________;
请你设计一个确定稀硫酸是否过量的实验方案,你选用的药品是________________,实验现象及结论是_______________________________________。