��Ŀ����
�����±���Ϣ�ش�:
��1����10��Ԫ�ص������� ����Ԫ�ص�ԭ��ʧȥ�����γɵ������ӷ����� �������ӽṹʾ��ͼ�� ��
��2����2���ڹ��� �ֹ���ǽ���Ԫ�أ�������Ԫ��ԭ�ӵĺ��� ����ͬ��
��3��9��Ԫ�غ�17��Ԫ�صĻ�ѧ�������Ƶ�ԭ�������ǵ� ����ͬ�� ZԪ�غ�8��Ԫ���γɻ�����Ļ�ѧʽΪ ��
| �� ���� | IA | | 0 | |||||
| 1 | 1 H 1.008 | ��A | ��A | ��A | V A | ��A | ��A | 2 He 4.003 |
| 2 | 3 Li 6.941 | 4 Be 9.012 | 5 B 10.8l | 6 C 12.01 | 7 N 14.0l | 8 O 16.00 | 9 F 19.00 | 10 Ne 20.18 |
| 3 |  | | | Z | | | | |
��1����10��Ԫ�ص������� ����Ԫ�ص�ԭ��ʧȥ�����γɵ������ӷ����� �������ӽṹʾ��ͼ�� ��
��2����2���ڹ��� �ֹ���ǽ���Ԫ�أ�������Ԫ��ԭ�ӵĺ��� ����ͬ��
��3��9��Ԫ�غ�17��Ԫ�صĻ�ѧ�������Ƶ�ԭ�������ǵ� ����ͬ�� ZԪ�غ�8��Ԫ���γɻ�����Ļ�ѧʽΪ ��
��1���� ��O2- 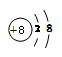 (2)2�����Ӳ�, (3) ��������, SiO2
(2)2�����Ӳ�, (3) ��������, SiO2
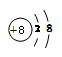 (2)2�����Ӳ�, (3) ��������, SiO2
(2)2�����Ӳ�, (3) ��������, SiO2�����������1������Ԫ�����ڱ���һ��С������ݷ�������10��Ԫ����Ne���ʻ�ѧ�������ʣ�ԭ�Ӻ�����������������4����һ������ʧȥ�����γ������ӣ�ԭ�Ӻ�����������������4���ģ�һ�����õ������γ������ӣ�������Ԫ�ص�ԭ�ӵ�����������Ϊ6������4���������õ�2�����Ӷ��ﵽ8�����ӵ�����ȶ��ṹ���γɴ�2����λ����ɵ������ӣ������ΪO2-�������ӽṹʾ��ͼ��
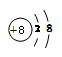 ��
����2������ԭ���������������ص�������ǽ���Ԫ�ص�ԭ���������ӵ���Ŀһ�����4��������Ԫ�ص�ԭ���������ӵ���Ŀһ������4�����ʵ�2���������ڷǽ���Ԫ�ص��� B��C��N��O��F������B��C���ڹ���ǽ���Ԫ�أ������ڵ�Ԫ��ԭ�ӵĺ�����Ӳ�������������ͬ��
��3��Ԫ�صĻ�ѧ������ԭ�Ӻ�������������������й�ϵ��ԭ�Ӻ����������������ͬ����ѧ�������ƣ�����9��Ԫ�غ�17��Ԫ�ص�ԭ�Ӻ������������������7�������ǵĻ�ѧ�������ơ�����ZԪ���ǵ�14��Ԫ�أ���ΪSi��8��Ԫ��ΪO���������γɻ�����Ļ�ѧʽΪSiO2��
�������������������Ԫ�����ڱ����ص㼰��Ӧ�ã��ǽ����Ĺؼ������ܸ���ԭ�ӽṹʾ��ͼ�ж�Ԫ�صĻ��ϼۣ�����ݻ��ϼ���д��ѧʽ��

��ϰ��ϵ�д�
 �п�������㾫��ϵ�д�
�п�������㾫��ϵ�д�
�����Ŀ
 ����ʳ�Ρ������й�˵��������ǣ� ��
����ʳ�Ρ������й�˵��������ǣ� �� 


 ��������3��ԭ�ӹ���
��������3��ԭ�ӹ��� ���͡�
���͡� �����ӵĸ�������3:2
�����ӵĸ�������3:2