题目内容
【题目】某化学兴趣小组同学对某铜锌合金样品进行探究实验.称取样品10.0克放入烧杯中,再用100.0克稀硫酸溶液逐滴滴入,实验情况如图所示.
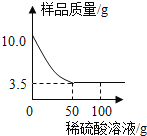
求:(1)铜锌合金中,Zn的质量分数是多少?
(2)反应后溶液中溶质的质量分数是多少?
【答案】(1)65% (2)15.1%
【解析】
试题分析:(1)锌的质量为10g﹣3.5g=6.5g.则铜锌合金中,Zn的质量分数是6.5g/10g×100%=65%
(2)设锌完全反应生成硫酸锌的质量为y,氢气的质量为z.
Zn+ H2SO4=ZnSO4+H2↑
65 161 2
6.5g y z
65/6.5g=161/y=2/z
y=16.1g z=0.2g
反应后溶液的质量为:100g+10g—3.5g—0.2g=106.3g
硫酸锌的质量分数:16.1g/106.3g×100%=15.1%

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案
相关题目
【题目】某同学利用“多米诺骨牌”效应,设计了如图气体制取与性质验证的组合实验,打开A中分液漏斗的活塞,很快看到E中导管口有气泡冒出,且溶液由紫色变红色。 请看图回答问题:
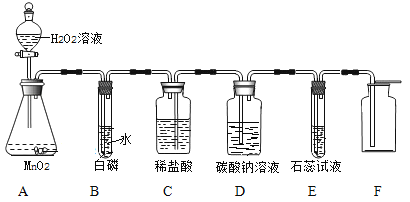
(1)A中反应的化学方程式 ;
B中白磷不燃烧,原因是 。
(2)C、D中看到的现象分别是 、
。
(3)用化学方程式表示E中颜色变化的原因 。
(4)将D中液体倒入试管中,对其成分进行探究:
实验操作 | 实验现象 | 结论 |
方法一:向试管中滴入 溶液 | 无色液体变白色浑浊 | 溶质中一定含有 碳酸钠和 |
方法二:向试管中放入镁条 | 气泡产生 |


