��Ŀ����
����Ŀ��ˮ����Һ�������������������������ʮ����Ҫ�����ã�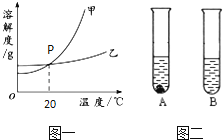
��1������ˮ�ľ��������У������˻���̿���ԣ����õ��������� ��
��2��ũҵ�����������ʵ���������Ϊ10%��20%��NaCl��Һ����ѡ���ӣ��ֽ�300g 25%��NaCl��Һϡ��Ϊ10%��NaCl��Һ����Ҫ��ˮ������Ϊ g��
��3���ס��������ʵ��ܽ��������ͼһ��ʾ��
��P��������
�ı�����Һ�л��������ң��ᴿ�ײ��õķ�������
��t��ʱ�����������ļס������ֹ��壬�ֱ����ʢ��10gˮ��A��B�Թ��У�����ܽ�ɹ۲쵽��ͼ����ʾ��������t20�棨���������������=������
���� t��ʱ����A�Թܽ������²���������A�Թ�����Һ���ʵ���������һ�������仯����������ĸ��ţ���
a��������ˮ b����������������
c������ d�����������ܼ����ָ���t��
���𰸡�
��1��������Cl2
��2��450
��3��20��ʱ�ס��������ʵ��ܽ����ȣ����½ᾧ������c
�������������⣺��1������ˮ�ľ��������У������˻���̿�������ԣ����õ���������Cl2����2����ϡ�ͺ���Һ����ΪX��300g��25%=X��10%���X=750g��
��Ҫ��ˮ������Ϊ750g��300g=450g����3����P��ĺ�����20��ʱ�ס��������ʵ��ܽ����ȣ��ڼ��ܽ�����¶ȱ仯Ӱ��ϴɲ�����ȴ�ȱ�����Һ�ķ����ᴿ�ף���t��ʱ�����������ļס������ֹ��壬�ֱ����ʢ��10gˮ��A��B�Թ��У�A���й���ʣ�࣬B��ȫ���ܽ⣬˵�����¶���A���ܽ�ȱ�B��С���ʸ��¶�С��20�棬�������
��A���ʵ��ܽ�����¶ȵ����߶������������£����й����ܽ⣬���������������������������������ʡ��������������ܼ������Ǹ��¶ȵı�����Һ���������������������䣬������ˮ������Ҳ���Ǹ��¶ȵı�����Һ���������������������䣮��ѡ��c��
�𰸣���1��������Cl2����2��450����3����.20��ʱ�ס��������ʵ��ܽ����ȣ����½ᾧ����������c��
��1�����ݻ���̿���������Խ�𣻳��õ���������������𣻣�2������ϡ��ǰ�����ʲ����е�ʽ��𣻣�3�����ݹ�����ܽ�����߿�֪����ij������һ���¶�ʱ���ܽ�ȣ��ڱȽϲ�ͬ������ͬһ�¶��µ��ܽ�ȴ�С���ۿ��Կ������ʵ��ܽ�����¶ȱ仯��Ӱ���С������Ӷ�ȷ������Һ�нᾧ�����ķ�����
�����㾫����������Ĺؼ���������ᾧ��ԭ������������Ӧ�õ����֪ʶ�����սᾧ�����ַ����������ܼ�����NaCl����ˮɹ�Σ��ͽ����¶ȣ���ȴ�ȵı�����Һ����KNO3�����Լ��Թ����ܽ�����������õ����⣬�˽�1������ָ���¶�ʱ���ʵ��ܽ�ȣ��������ܽ���ж��ܽ��ԣ�2���Ƚ���ͬ�¶�ʱ����һ���¶ȷ�Χ�ڣ���ͬ�����ܽ�ȵĴ�С��3���ȽϺ�ȷ�����ʵ��ܽ�����¶�Ӱ��ij̶ȣ����ݴ�ȷ�����ʽᾧ����������ᴿ�ķ�����4��ȷ����Һ��״̬�������벻���ͣ���

 Сѧ��10���ӿ������100��ϵ�д�
Сѧ��10���ӿ������100��ϵ�д�