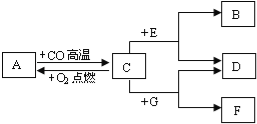
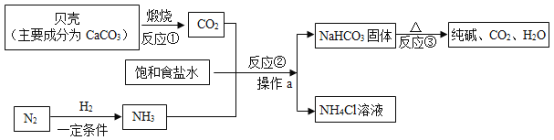
题目内容
【题目】足量的镁、铁分别和等量的盐酸反应,产生的氢气质量与时间的关系如图所示,下列说法不正确的是( )
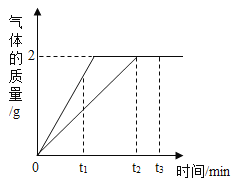
A.t1时,产生氢气的质量镁比铁多
B.t2时,镁、铁消耗的盐酸质量相同
C.t2时,镁、铁与盐酸都恰好完全反应
D.t3时,参加反应铁的质量是5.6 g
【答案】CD
【解析】
将等质量的镁和铁分别放入等质量、相同质量分数的稀盐酸中,镁比铁活泼,金属镁与酸反应产生氢气的速率比铁与酸反应产生氢气的速率快,通过图象可知金属镁先反应达到2g氢气,并结合化学方程式的计算可推出金属和酸的用量。
A、通过图象中的数据可以看出,t1时,产生氢气的质量镁比铁多,A选项正确,不符合题意;
B、依据质量守恒定律可知,生成氢气的氢元素全部来自稀盐酸,所以t2时,镁、铁消耗的盐酸质量相同,B选项正确,不符合题意;
C、每24份质量的镁会生成2份质量的氢气,每56份质量的铁会生成2份质量的氢气,生成的氢气质量相等,所以镁有剩余,C选项错误,符合题意;
D、t3时,金属的质量是过量的,每56份质量的铁会生成2份质量的氢气,生成氢气的质量是2g,所以参加反应铁的质量是56g,D选项错误,符合题意。故选CD。

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目