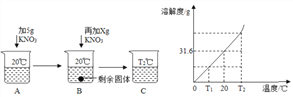
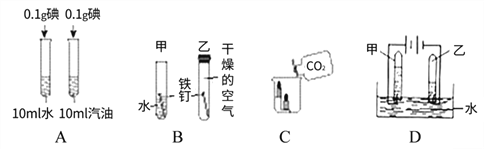
题目内容
【题目】某化工厂的废水中含有亚硫酸钠(Na2SO3),若直接排放会造成污染。化学兴趣小组对该厂的废水处理设计了下图所示的实验方案:

(提示:Na2SO3 + CaC12 = CaSO3↓ + 2NaCl;CaC12不与废水中的其它杂质反应)
(1)氯化钙的相对分子质量是_________。
(2)反应生成亚硫酸钙沉淀的质量为_________g。
(3)求废水中亚硫酸钠的质量分数为_________(写出计算过程,结果精确到0.1%)。
【答案】 111 6 12.6%
【解析】(1)氯化钙的相对分子质量=40+35.5![]() 2=111;(2)根据质量守恒定律可得,生成的亚硫酸钙的质量为50g+50g-94g=6g;
2=111;(2)根据质量守恒定律可得,生成的亚硫酸钙的质量为50g+50g-94g=6g;
设亚硫酸钠的质量为x,
Na2SO3+CaCl2═CaSO3↓+2NaCl
126 120
x 6g
![]()
x=6.3g,
废水中亚硫酸钠的质量分数为:![]() ×100%=12.6%。
×100%=12.6%。

【题目】某化学实验小组对 “影响石灰石与盐酸反应速率的因素——盐酸的浓度和石灰石的颗粒大小等”进行了如下实验探究,请你参与。
[进行实验]室温下,选用20mL不同溶质质量分数的盐酸(4%和6%)分别与1g颗粒状或块状的石灰石进行实验(固定夹持仪器略去)。
(1)石灰石与盐酸反应的化学方程式为___________________。
(2)按如图装置进行实验,在装药品前应检查该装置的气密性,具体的做法是____。
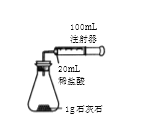
开始实验时,应将20mL稀盐酸_____________(填“快速”或“缓慢”)推入锥形瓶中,以保证盐酸能全部推入锥形瓶中。
[处理数据](3)实验小组进行实验后,获得的相关实验数据如表所示:
实验 编号 | 盐酸的溶质质量分数 (均取20mL) | 石灰石固体形状 (均取1g) | 二氧化碳的体积/mL (均收集前30s的气体) |
a | 4% | 颗粒 | 64.0 |
b | 4% | 块状 | 40.4 |
c | 6% | 颗粒 | 98.2 |
d | 6% | 块状 | 65.3 |
①要比较不同溶质质量分数的盐酸对反应速率的影响,可选择的实验编号是_______(写一组),由此可得到的结论是_______________。
②从上述实验得出石灰石的颗粒大小对反应速率影响的结论是_____________。
(4)如表是实验时记录生成的二氧化碳气体的体积和对应的时间的一组实验数据(每间隔4s读数一次):
时间/s | 4 | 8 | 12 | 16 | 20 | 24 | 28 | 3 | 36 | 40 | |
气体体积/mL | 16.0 | 22.2 | 29.4 | 39.3 | 50.4 | 57.6 | 62.0 | 64.7 | 66.0 | 66.0 |
从上表数据可以分析得出,到20s后反应速率逐渐变____,其主要原因是___。
(5)你认为影响石灰石与盐酸反应速率的因素还有____,请设计实验方案验证你的猜想:____