题目内容
【题目】实验小组的同学欲对碳朱氧化铜生成的气体成分进行探究。
(1)[提出猜想]气体成分为①只有CO,②只有CO2 , ③CO和CO2的混合气体。得出以上猜想的依据是。
[实验设计]将生成的气体通入如图装置一段时间,发现C中液体变浑浊,由此排除了猜想(填序号)。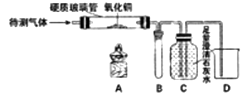
先通气体一会后,点燃酒精灯,先预热,后对准玻璃管中的氧化铜加热,出现现象,说明猜想③成立。
(2)[交流与讨论]将生成气体通入装置一段时间再加热,除探究CO2存在外,还能达到的目的是。
请写出一个该实验产生CO可能发生的化学反应的化学方程式。
装置B可以防止液体回流使玻璃管炸裂,装置C的作用是。
【答案】
(1)质量守恒定律(或反应前后元素种类不变);①;C中石灰水变浑浊,加热玻璃管内黑色固体变红色
(2)排尽装置内的空气,以免加热时发生爆炸事故;C+CO2 ![]() 2CO或C+CuO
2CO或C+CuO ![]() Cu+CO↑;证明是否有CO2 , 收集CO
Cu+CO↑;证明是否有CO2 , 收集CO
【解析】[提出猜想]气体的成分有这三种可能的依据:质量守恒定律(或反应前后元素种类不变);
[实验设计]将生成的气体通入澄清石灰水中,发现变浑浊,说明生成气体中一定含有CO2 , 即猜想①不正确,应排除;加热氧化铜一段时间,出现最初通气体时C中石灰水变浑浊,说明有CO2 , 加热后玻璃管内黑色固体变红色,说明有CO气体,则猜想③成立;
[交流与讨论]先将生成的气体,除探究CO2存在外,还能排尽装置内的空气,以免加热时发生爆炸事故;C和CuO在加热条件下反应生成铜和CO,或碳和CO2在加热条件下生成CO,发生的化学反应的化学方程式为C+CO2 ![]() 2CO或C+CuO
2CO或C+CuO ![]() Cu+CO↑;
Cu+CO↑;
装满石灰水的C装置可通过是否变浑浊证明是否有CO2 , 还可以收集CO。
[提出猜想]碳和氧化铜混合加热生成铜和气体,根据反应前后元素种类不变,则组成气体的元素一定是碳和氧元素,故有三种可能;
[实验设计]澄清石灰水遇二氧化碳会变浑浊,石灰水变浑浊,一定有二氧化碳;一氧化碳有还原性,可以使黑色氧化铜变成红色;实验开始前通入的气体可以尽装置内的空气,防止加热一氧化碳和空气的混合气体发生爆炸。碳和CO2在加热条件下生成CO;装满石灰水的C装置可通过是否变浑浊证明是否有CO2 , 还可以收集CO。

 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案【题目】鉴别下列各组物质的方法不正确的是![]()
选项 | 鉴别的物质 | 鉴别的方法 |
A | 冰和干冰 | 室温放置,过一段时间观察是否有液体残留 |
B | 水和过氧化氢溶液 | 加二氧化锰,观察是否有气泡 |
C | 纯水和矿泉水 | 观察是否澄清 |
D | 二氧化碳和一氧化碳 | 点燃,观察是否能燃烧 |
A. A B. B C. C D. D
【题目】将一定量的丙烷(C3H8)和氧气置于一个密闭的容器中引燃并充分反应,测得反应前后各物质的质量如表所示,下列判断不正确的是( )
物质 | C3H8 | O2 | H2O | CO2 | X |
反应前质量/g | 4.4 | 12.8 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 7.2 | 4.4 | a |
A.表中a的值一定是5.6
B.若8.8g丙烷完全反应,则生成14.4g水
C.生成物X中一定含有氢元素
D.若4.4g丙烷与16.0g氧气充分反应,则无X生成
【题目】对物质的性质进行比较归纳,有利于更好的学习化学。
温度℃ | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | |
溶 | 氢氧化钠 | 51 | 109 | 119 | 129 | 145 | 174 | 299 | 314 | 329 |
氢氧化钙 | 0.17 | 0.16 | 0.15 | 0.14 | 0.13 | 0.12 | 0.105 | 0.095 | 0.08 | |
(1)分析数据:相同温度下的饱和溶液中,氢氧化钠溶液中溶质质量分数氢氧化钙溶液中溶质质量分数(选填“>”、“<”、“=”)。
(2)实验探究:向充满二氧化碳的塑料瓶中分别倒入等量的水、澄清石灰水、氢氧化钠饱和溶液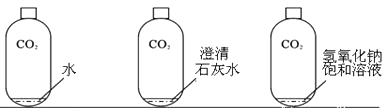
瓶1变瘪(选填“能”或“不能”)说明二氧化碳和水发生化学反应,你的理由是。
(3)实验中,观察到只有瓶2中液体变浑浊,用化学方程式表示其原理。瓶2和瓶3塑料瓶均变瘪,但瓶3变形更为明显,原因是。
(4)取塑料瓶3中反应后的溶液,甲同学滴加足量的稀盐酸,如果有 , 说明有新物质产生,证明CO2与NaOH发生了反应。乙同学选择了一种盐溶液,丙同学也选择了一种溶液,该溶液中溶质与甲、乙同学所用溶液中溶质的物质类别不同,他们都能达到检验目的。你认为丙同学所选溶液中的溶质可能是(填一种物质的化学式)。
(5)兴趣小组的同学对塑料瓶3反应后的液体进行探究。
【提出问题】该溶液中含有哪些溶质?
【作出猜想】猜想Ⅰ溶质为NaOH
猜想Ⅱ:溶质为Na2CO3
猜想Ⅲ:溶质为NaOH和Na2CO3
【实验探究】同学们在老师的带领下设计实验,对猜想进行验证。
方案1:蘸取少量溶液滴到pH试纸上,与标准比色卡比较,pH大于7,有同学认为溶液中一定含有NaOH。
方案2:先向溶液中加入溶液,看到有白色沉淀产生,该反应的化学方程式为;然后向上层清液中加入溶液,看到溶液呈红色,验证了猜想Ⅲ是正确的。
(6)【实验反思】由方案2的结果可知,方案1的结论错误,理由是。