题目内容
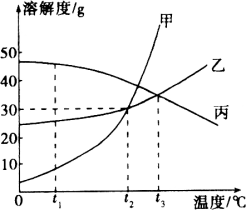
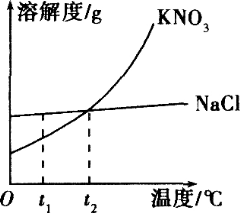
【题目】图是氯化钠和硝酸钾两种固体物质的溶解度曲线.
某兴趣小组为了研究NaCl和KNO3的溶解和结晶,做了两组实验(室温下),其过程如下:
[第一组]

[第二组]

(1)①中溶质的质量分数为________________,⑨的现象是________________.
(2)第一组实验中操作a为________,所得氯化钠固体质量增多可能是下列原因中的(填字母序号)________.
A.溶解NaCl固体时,没有用玻璃棒搅拌
B.称量5g NaCl固体后,称量纸上仍留有固体
C.蒸发时,未及时停止加热,有固体溅出
D.蒸发后所得NaCl固体中仍含有水分
(3)上述实验过程中一定属于饱和溶液的是(填数字序号,下同)________,溶质与溶剂质量比一定相等的是________.
【答案】(1)20% 有晶体析出 (2)蒸发 D (3)②⑥⑨ ①和⑤(或⑥和⑨)
【解析】(2)由于氯化钠的溶解度受温度影响比较小,所以使氯化钠从溶液中结晶的方法一般采用蒸发溶剂的方法,当溶液达到饱和后继续蒸发会有白色晶体析出;所得氯化钠晶体的质量为11g,大于10g,可能原因为蒸发所得的氯化钠固体中仍含有水分.
(3)确定溶液是否饱和,关键要看该温度下能否继续溶解该溶质,不能继续溶解该溶质的溶液是饱和溶液,能继续溶解的是不饱和溶液.②⑥⑨中均有不能继续溶解的溶质存在,故实验过程中所得溶液一定达到饱和的是②⑥⑨;①和⑤中20g水中溶解的溶质质量相等,故溶质与溶剂的质量比一定相等;⑥、⑨都是同一温度下硝酸钾的饱和溶液,故溶质与溶剂的质量比也一定相等.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
相关题目